题目内容
4.将25g石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(假设杂质不溶解,也不参加反应)后称得烧杯中物质的总质量为116.2g.(1)反应生成的CO2质量为8.8g
(2)计算所用盐酸的溶质的质量分数.
分析 分析所发生的反应,可发现反应后总质量减轻是由于生成了气体二氧化碳,因此,可知恰好完全反应时放出二氧化碳的质量为8.8g;然后利用二氧化碳的质量,根据反应的化学方程式,分别计算恰好完全反应时HCl的质量,最后使用质量分数的计算公式,求出所用盐酸的质量分数.
解答 解:(1)生成二氧化碳的质量=25 g+100 g-116.2 g=8.8 g
(2)设所用稀盐酸中HCl的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
x 8.8g
$\frac{73}{x}=\frac{44}{8.8g}$
x=14.6 g
所用稀盐酸中溶质的质量分数=$\frac{14.6g}{100g}$×100%=14.6%
答:(1)生成二氧化碳的质量为8.8 g
(2)所用稀盐酸中溶质的质量分数为14.6%
点评 根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算.

练习册系列答案
相关题目
15.向16g黄铜(由锌、铜形成的合金)样品中加入148.4g稀硫酸恰好完全反应,生成氢气质量为0.4g,则所得溶液中溶质的质量分数可能为( )
| A. | 8% | B. | 10% | C. | 19.6% | D. | 20% |
12.下列有关物质用途的说法中,错误的是( )
| A. | .盐酸可用于食品工业 | B. | 用氢氧化钠改良酸性土壤 | ||
| C. | .硫酸用于车用电池 | D. | .氢氧化钙用作建筑材料 |
16.乙酸乙酯(C4H8O2)常用作食品、饮料的调香剂.下列叙述正确的是( )
| A. | 乙酸乙酯是有14个原子构成 | |
| B. | 乙酸乙酯中含有一个氧分子 | |
| C. | 乙酸乙酯中碳、氢、氧元素的质量比为12:1:16 | |
| D. | 一个乙酸乙酯分子中,碳、氢、氧原子的个数比为2:4:1 |
14.下列物质在密闭容器内混合遇明火可能发生爆炸的是( )
| A. | H2和空气 | B. | H2和天然气 | C. | N2 和O2 | D. | CH4和CO2 |
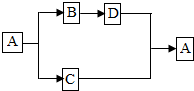 A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产物已略去);若A是一种白色难溶于水、相对分子质量为100的化合物,则B的化学式是CaO;若A是一种常见的无色液体,D是一种黑色固体.则由B生成D的化学方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产物已略去);若A是一种白色难溶于水、相对分子质量为100的化合物,则B的化学式是CaO;若A是一种常见的无色液体,D是一种黑色固体.则由B生成D的化学方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.