题目内容
20.下列错误的一组是( )| A.食物中的化学 | B.数字中的化学-“2”的含义 |
| ①“高钙牛奶”中“钙”指钙元素 ②氮气充入食品包装内以防腐 | ①Mg2+:一个镁离子带两个单位正电荷 ②$\stackrel{+2}{Mg}$O:氧化镁中镁的化合价为正二价 |
| C.材料中的化学 | D.生产中的化学 |
| ①铝制品抗腐蚀性好,因为铝不活泼 ②合金的硬度比纯金属的硬度小 | ①面粉加工厂要严禁烟火 ②工业炼铁的原理为CO还原Fe2O3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据物质的组成,氮气的性质分析;
B、标在元素符号右上角的数字表示离子所带电荷数,标在元素符号正上方的数字表示该元素化合价的数值;
C、根据铝的自我保护和合金的特点分析;
D、运用面粉粉尘遇火会发生爆炸和炼铁的原理分析解答.
解答 解:A、日常生活中,高钙牛奶中的“钙”是强调存在的元素,氮气的化学性质不活泼,一般不与其它物质发生反应,可充入食品包装内防腐,故说法正确.
B、标在元素符号右上角的数字表示离子所带电荷数,Mg2+:一个镁离子带两个单位正电荷,标在元素符号正上方的数字表示该元素化合价的数值,$\stackrel{+2}{Mg}$O:氧化镁中镁的化合价为正二价,故说法正确.
C、铝制品耐腐蚀主要是因为铝能与空气中的氧气反应生成一层致密氧化膜,合金的硬度比纯金属的硬度大,故错误;
D、面粉粉尘遇火会发生爆炸,所以要严禁烟火;工业炼铁的原理为CO还原Fe2O3生成铁的单质,故正确;
故选:C.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
4.一辆客车夜晚行驶在公路上,发现油箱漏油,车厢里充满了汽油的气味,这时应该采取的应急措施是( )
| A. | 洒水降温并溶解汽油蒸气 | |
| B. | 打开所有车窗,严禁一切烟火,疏散乘客离开车厢 | |
| C. | 开灯查找漏油部位,及时修理 | |
| D. | 让车内乘客坐好,不要随意走动 |
5. 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某科学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜 想正确 |
| 乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加酚酞试液. | 溶液由无色 变为红色 | 自己的猜 想正确 |
【提出问题2】溶液B中溶质的成分是什么?加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
15. 石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
(1)上表中m的数值是4.4.
(2)所用盐酸溶液的溶质质量分数?
(3)在图中画出石灰石与生成二氧化碳的关系图
(4)某同学计算碳酸钙的质量分数过程如下:
设15克石灰石中碳酸钙的质量为x
根据化学方程式列关系式为:$\frac{100}{x}$=$\frac{44}{4.4g}$ 求得:x=10g,碳酸钙的质量分数为10g/15g×100%=66.7%,你认为正确么?如正确本题可不答,如不正确,请说明理由15g石灰石样品没有完全反应.
 石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(2)所用盐酸溶液的溶质质量分数?
(3)在图中画出石灰石与生成二氧化碳的关系图
(4)某同学计算碳酸钙的质量分数过程如下:
设15克石灰石中碳酸钙的质量为x
根据化学方程式列关系式为:$\frac{100}{x}$=$\frac{44}{4.4g}$ 求得:x=10g,碳酸钙的质量分数为10g/15g×100%=66.7%,你认为正确么?如正确本题可不答,如不正确,请说明理由15g石灰石样品没有完全反应.
5.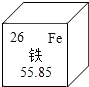 酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
 酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )
酱油加铁是以强化营养为目的,能有效控制缺铁性贫血.下列有关铁的说法正确的是( )| A. | 中子数为26 | B. | 核外电子数为26 | ||
| C. | 相对原子质量为55.85g | D. | 地壳中含量最高的金属元素 |
12.MnO2是KClO3分解的催化剂.某化学兴趣小组发现,CuO也能加快KClO3的分解,该实验小组进行了如下探究.【提出猜想】除MnO2外,CuO也可作KClO3分解的催化剂.
【实验探究】按下表进行实验并获得相关数据
【分析数据得出结论】
(1)实验中均取用5gKClO3,目的是控制变量
(2)由实验A与实验C对比,证明猜想合理的理由是加入氧化铜后氯酸钾分解产生氧气的温度比只加热氯酸钾时产生氧气的温度低很多.
(3)相同条件下对氯酸钾分解催化效果最好的是MnO2.
【实验反思】
(1)若要确定氧化铜是该反应的催化剂,还要证明其在化学反应前后化学性质和质量不变.
(2)同种催化剂,质量多少可能影响KClO3分解的催化效果,请设计实验方案进行验证分别取相同质量的颗粒大小相同的氯酸钾,与质量不同的二氧化锰混合加热制氧气,质量多的反应的速率快.
(3)除以上因素外,还有哪些因素可能影响KClO3分解的催化效果,请再探究(探究一种因素即可)
【实验探究】按下表进行实验并获得相关数据
| 实验编号 | 实验药品及用量 | 分解温度(℃) |
| A | 5gKClO3 | 580 |
| B | 5gKClO3、1gMnO2 | 350 |
| C | 5gKClO3、1gCuO | 370 |
(1)实验中均取用5gKClO3,目的是控制变量
(2)由实验A与实验C对比,证明猜想合理的理由是加入氧化铜后氯酸钾分解产生氧气的温度比只加热氯酸钾时产生氧气的温度低很多.
(3)相同条件下对氯酸钾分解催化效果最好的是MnO2.
【实验反思】
(1)若要确定氧化铜是该反应的催化剂,还要证明其在化学反应前后化学性质和质量不变.
(2)同种催化剂,质量多少可能影响KClO3分解的催化效果,请设计实验方案进行验证分别取相同质量的颗粒大小相同的氯酸钾,与质量不同的二氧化锰混合加热制氧气,质量多的反应的速率快.
(3)除以上因素外,还有哪些因素可能影响KClO3分解的催化效果,请再探究(探究一种因素即可)
| 提出猜想 | |
| 设计方案 | |
| 得出结论 |
10.氧气的化学性质比较活泼,能与多种物质反应.下列对有关反应的描述正确的是( )
| A. | 铁丝在氧气中剧烈燃烧,火星四射,生成黑色的三氧化二铁 | |
| B. | 硫在氧气里燃烧,发出蓝紫色火焰,生成无色无味的气体 | |
| C. | 铁、硫、酒精在氧气中的燃烧都是化合反应 | |
| D. | 物质与氧气发生的反应属于氧化反应 |
