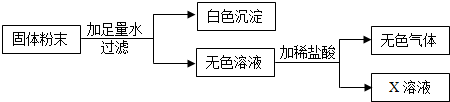
题目内容
3.工业烧碱具有较好的杀菌消毒作用,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学要测定工业烧碱样品纯度,进行了如下实验:【原理思路】利用Na2CO3与足量稀HCl反应产生CO2,通过对CO2质量的测定,确定样品中碳酸钠的质量,从而计算样品的纯度.
【实验方案】小科同学根据以上思路,设计了如图的实验方案(固定装置省略,装置气密性良好,每步反应或作用都是完全的),装置中通过对a、b、c三个弹簧夹的控制,在样品与稀盐酸反应前和停止反应后,都通入过量的空气.

【分析计算】实验前加入样品10g,溶于50g水中,通入过量空气后加入稀盐酸50g,充分反应后,通入过量的空气,测得D装置反应前后增加的质量为2.2g,求:工业烧碱样品中氢氧化钠的质量分数?
【反思与交流】小明认为上述实验方案的设计还有一点缺陷,若按该方案进行测定CO2质量还会产生误差.为减少误差,使CO2质量的测定更准确,小组同学经过讨论,认为应该在BC之间增加一个装饱和碳酸氢钠溶液的洗气瓶(饱和碳酸氢钠溶液可以吸收二氧化碳中混有的氯化氢气体).小组中有个别同学提出不同意见,认为该实验没必要对实验装置进行改进,只要利用Na2CO3与足量稀硫酸反应即可解决问题.
分析 (1)根据二氧化碳和氢氧化钠反应生成碳酸钠和水,D装置反应前后增加的质量为2.2g,就是二氧化碳的质量,即可求得碳酸钠的质量,进而求出氢氧化钠的质量分数;
(2)根据饱和碳酸氢钠溶液可以吸收二氧化碳中混有的氯化氢气体需要在浓硫酸除去水蒸气之前,以及稀硫酸不具有挥发性,可以将稀盐酸换成稀硫酸即可解决问题.
解答 解:(1)生成二氧化碳的质量为2.2g,设样品中含有碳酸钠质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
$\frac{106}{x}$=$\frac{44}{2.2g}$
x=5.3g
所以工业烧碱样品中氢氧化钠的质量分数为:$\frac{10g-5.3g}{10g}$×100%=47%;
(2)饱和碳酸氢钠溶液可以吸收二氧化碳中混有的氯化氢气体需要在浓硫酸除去水蒸气之前,所以应该在BC之间增加一个装饱和碳酸氢钠溶液的洗气瓶,稀硫酸不具有挥发性,可以将稀盐酸换成稀硫酸即可解决问题.
故答案为:(1)47%;
(2)BC,稀硫酸.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的提示进行解答.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
13.下列装置或操作能达到实验目的是( )
| A. |  分离氢氧化钡溶液和盐酸反应后的生成物 | |
| B. |  收集CO2气体 | |
| C. |  检验二氧化碳是否收集满 | |
| D. |  确认CO2和NaOH已发生反应 |
14.X、Y两金属都能与AgNO3溶液反应,置换出Ag;X跟H2SO4不反应,Y跟H2SO4反应生成H2,由此判断X、Y可能依次是( )
| A. | Fe,Hg | B. | Fe,Zn | C. | Cu,Hg | D. | Cu,Zn |
11.柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以电离出H+,主要用于香料或作为饮料的酸化剂.下列物质不能与柠檬酸发生反应的是( )
| A. | Mg | B. | K2O | C. | CO2 | D. | NaOH |
18.规范实验操作是获得实验成功的重要保证,如图实验操作正确的是( )
| A. |  滴加氯化钙溶液 | |
| B. |  称量氢氧化钠 | |
| C. |  测溶液的PH值 | |
| D. |  稀释浓硫酸 |
15.读“我国部分城市空气质量周报(2009年3月的某周)”的有关统计数据,回答以下问题:
(1)这些城市中空气质量最好的是厦门;
(2)杭州的首要污染物是TSP或可吸入颗粒物;
(3)最容易出现酸雨的城市是重庆;请写出防治酸雨的一种方法开发新能源,植树造林.
(4)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的主要污染物之一,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂),它的特点是使CO和NO反应,生成可参与大气生态环境循环的两种无毒气体,其中一种能使澄清石灰水变浑浊,另一种是空气中最多的气体.请写出CO和NO反应化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | II |
| 上海 | 74 | NOx | II |
| 杭州 | 67 | TSP | II |
| 重庆 | 98 | SO2 | II |
| 厦门 | 25 | I | |
| 注:可吸入颗粒物为TSP;氮氧化物为NOx;二氧化硫为SO2 | |||
(2)杭州的首要污染物是TSP或可吸入颗粒物;
(3)最容易出现酸雨的城市是重庆;请写出防治酸雨的一种方法开发新能源,植树造林.
(4)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的主要污染物之一,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂),它的特点是使CO和NO反应,生成可参与大气生态环境循环的两种无毒气体,其中一种能使澄清石灰水变浑浊,另一种是空气中最多的气体.请写出CO和NO反应化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.