题目内容
17.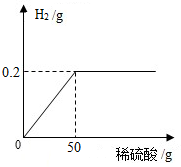 为了定量分析黄铜(铜锌合金)的组成,化学小组进行了如下实验,称取20g黄铜样品放入烧杯中,再缓慢加入适量稀硫酸并不断搅拌,测得生成的氢气与所用稀硫酸的质量关系如图所示.求:
为了定量分析黄铜(铜锌合金)的组成,化学小组进行了如下实验,称取20g黄铜样品放入烧杯中,再缓慢加入适量稀硫酸并不断搅拌,测得生成的氢气与所用稀硫酸的质量关系如图所示.求:(1)黄铜样品中锌的质量.
(2)所用稀硫酸的溶质质量分数.
分析 根据锌和硫酸反应生成硫酸锌,结合图象可以看出生成氢气的质量是0.2g,计算参加反应的锌的质量和硫酸的质量,然后计算稀硫酸的质量分数.
解答 解:设锌的质量为x,硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=9.8g
所以所用稀硫酸的溶质质量分数为:$\frac{9.8g}{50g}$×100%=19.6%
故答案为:(1)6.5g;
(2)19.6%.
点评 本题考查的是根据化学方程式的计算,完成此题,可以依据已有的知识结合图象进行.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
7.下列因素的改变,能显著改变气体体积的是( )
| A. | 微粒间的空隙 | B. | 微粒的大小 | C. | 微粒的质量 | D. | 微粒的种类 |
8.水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是( )
| A. | 过滤法 | B. | 蒸馏法 | C. | 分液法 | D. | 萃取法 |
5.下列反应属于化合反应的是( )
| A. | 水--氧气+氢气 | B. | 氧化汞--汞+氧气 | ||
| C. | 铝+氧气--氧化铝 | D. | 石蜡+氧气--二氧化碳+水 |
2. 如图所示的实验目的是探究物质燃烧的条件,下列说法不正确的是( )
如图所示的实验目的是探究物质燃烧的条件,下列说法不正确的是( )
 如图所示的实验目的是探究物质燃烧的条件,下列说法不正确的是( )
如图所示的实验目的是探究物质燃烧的条件,下列说法不正确的是( )| A. | 可燃物在温度达到其着火点以上时就会燃烧 | |
| B. | 水中白磷不能燃烧是因为白磷没有与氧气接触 | |
| C. | 红磷不能燃烧说明温度要达到可燃物的着火点以上 | |
| D. | 实验中薄铜片的作用是利用铜片的导热性给物质加热 |
9.课外小组同学进一步研究铁与氧气的反应.
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】生铁中含有一定量的碳.铁丝燃烧时“火星四射”现象与铁丝中含碳量有关.
【进行实验】探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系.
【提出问题】纯铁在氧气中燃烧溅落的“黑色固体”是什么?
【查阅资料】
①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO易被氧化)
②铁的氧化物均能溶于酸溶液
③单质铁与稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
【进行实验】测定黑色固体的成分.
【实验反思】
同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验.若用排水集气法收集一瓶体积分数约为60%的氧气,预先应向容积为250mL的集气瓶中加水,水的体积约为125mL.
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】生铁中含有一定量的碳.铁丝燃烧时“火星四射”现象与铁丝中含碳量有关.
【进行实验】探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系.
| 实验 | 现象 | 解释与结论 |
| 实验1:取直径0.20mm、含碳0.1% 的铁丝,在氧气中燃烧 | 零星的火星四射 | ①铁燃烧的化学方程式是3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4. ②0.20mm的铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为含碳量越高,火星四射的现象越明显 |
| 实验2:取直径0.20mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
| 实验3:取直径0.20mm、含碳0.52%的铁丝,在氧气中燃烧 | 明显的火星四射 |
【查阅资料】
①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO易被氧化)
②铁的氧化物均能溶于酸溶液
③单质铁与稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
【进行实验】测定黑色固体的成分.
| 实验 | 现象及数据 | 解释与结论 |
| 实验4:将冷却后的黑色固体碾碎,装入试管,加入稀盐酸 | 现象是有气泡产生 | 铁燃烧时溅落下来的黑色 固体中含有铁 |
| 实验5:取2.8g纯铁在氧气中燃烧,收集溅落的黑色固体,干燥并称其质量 | 黑色固体质量为3.44g | 黑色固体的组成及质量 为Fe1.12g,Fe3O42.32g |
同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验.若用排水集气法收集一瓶体积分数约为60%的氧气,预先应向容积为250mL的集气瓶中加水,水的体积约为125mL.
6.保护环境,人人有责.下列符合这一要求的是( )
| A. | 废旧电池随意丢弃、污染水土,不会通过食物链危及人类健康 | |
| B. | 全面关停化工企业,以防污染环境 | |
| C. | 为了增产,蔬菜、瓜果、粮食多用农药和化肥 | |
| D. | 工业废水、生活污水处理达标后在排放 |
7.根据三种不同的原子(如表所示),则下列说法正确的是( )
| A 原子 | B原子 | C原子 | |
| 质子数 | 8个 | 8个 | 7个 |
| 中子数 | 8个 | 9个 | 7个 |
| A. | A和C是同一种元素 | B. | B和C核外电子数相等 | ||
| C. | A和B是同种元素 | D. | A和B的核电荷数不同 |