题目内容
9.课外小组同学进一步研究铁与氧气的反应.【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】生铁中含有一定量的碳.铁丝燃烧时“火星四射”现象与铁丝中含碳量有关.
【进行实验】探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系.
| 实验 | 现象 | 解释与结论 |
| 实验1:取直径0.20mm、含碳0.1% 的铁丝,在氧气中燃烧 | 零星的火星四射 | ①铁燃烧的化学方程式是3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4. ②0.20mm的铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为含碳量越高,火星四射的现象越明显 |
| 实验2:取直径0.20mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
| 实验3:取直径0.20mm、含碳0.52%的铁丝,在氧气中燃烧 | 明显的火星四射 |
【查阅资料】
①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO易被氧化)
②铁的氧化物均能溶于酸溶液
③单质铁与稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
【进行实验】测定黑色固体的成分.
| 实验 | 现象及数据 | 解释与结论 |
| 实验4:将冷却后的黑色固体碾碎,装入试管,加入稀盐酸 | 现象是有气泡产生 | 铁燃烧时溅落下来的黑色 固体中含有铁 |
| 实验5:取2.8g纯铁在氧气中燃烧,收集溅落的黑色固体,干燥并称其质量 | 黑色固体质量为3.44g | 黑色固体的组成及质量 为Fe1.12g,Fe3O42.32g |
同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验.若用排水集气法收集一瓶体积分数约为60%的氧气,预先应向容积为250mL的集气瓶中加水,水的体积约为125mL.
分析 【进行实验】根据铁和氧气在点燃的条件下生成四氧化三铁,以及铁在氧气燃烧的现象和控制变量法进行分析;
【进行实验】根据铁和盐酸反应生成氯化亚铁和氢气,铁和氧气在点燃的条件下生成四氧化三铁,然后结合题中的数据进行解答;
【实验反思】根据空气中也含有氧气,氧气约占空气总体积的五分之一,氧气的总体积应是通入的氧气的体积加上通入的空气中含有的氧气的体积;然后根据氧气的体积分数约为60%,列等式进行计算.
解答 解:【进行实验】铁和氧气在点燃的条件下生成四氧化三铁,铁在氧气燃烧的现象是剧烈燃烧,火星四射,生成黑色固体,通过对比可知铁丝含碳越高,火星越多,铁丝在氧气中燃烧产生火星四射现象与含碳量有关,所以
| 实验 | 现象 | 解释与结论 |
| 实验1:取直径0.20mm、含碳0.1% 的铁丝,在氧气中燃烧 | 零星的火星四射 | ①铁燃烧的化学方程式是:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 ②0.20mm的铁丝在氧气中燃烧“火星四射”与其含碳量的关系:含碳量越高,火星四射的现象越明显 |
| 实验2:取直径0.20mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
| 实验3:取直径0.20mm、含碳0.52%的铁丝,在氧气中燃烧 | 明显的火星四射 |
设参加反应的铁的质量为x,生成的四氧化三铁为y,
3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,
168 232
x y
$\frac{168}{x}$=$\frac{232}{y}$所以y=$\frac{232x}{168}$
2.8g-x+$\frac{232x}{168}$=3.44g
x=1.68
剩余的铁为:2.8g-1.68g=1.12g,生成的四氧化三铁为:3.44g-1.12g=2.32g
| 实验 | 现象及数据 | 解释与结论 |
| 实验4:将冷却后的黑色固体碾碎,装入试管,加入稀盐酸溶液 | 现象是有气泡产生 | 铁燃烧时溅落下来的黑色 固体中含有铁 |
| 实验5:取2.8g纯铁在氧气中燃烧,收集溅落的黑色固体,干燥并称其质量 | 黑色固体质量为3.44g | 黑色固体的组成及质量为: Fe1.12g,Fe3O42.32g |
x=125mL.
故答案为:【进行实验】
| 实验 | 现象 | 解释与结论 |
3Fe+2O2 $\frac{\underline{\;点燃\;}}{\;}$Fe3O4 含碳量越高,火星四射的现象越明显 | ||
| 明显的火星四射 |
| 实验 | 现象及数据 | 解释与结论 |
| 有气泡产生 | ||
| Fe1.12g,Fe3O42.32g |
点评 本题应考虑氧气的总体积应是通入的氧气的体积加上通入的空气中含有的氧气的体积,才能表示氧气的浓度80%.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
1.下列对酸的认识正确的是( )
| A. | 浓盐酸有吸水性,可以做干燥剂 | |
| B. | 浓盐酸有挥发性,通常不用于制取氢气 | |
| C. | 稀盐酸、稀硫酸有相似的化学性质,是因为它们的溶液中都有水分子 | |
| D. | 酸和碱能发生中和放应,根据这一原理用熟石灰来改良酸性土壤 |
19.具有10个电子的n价金属离子,其中子数为N,质子数为Z.N和Z的关系是N=Z+1,则该金属的近似相对原子质量是( )
| A. | N+Z+10 | B. | N+Z+1 | C. | N+Z+n | D. | 2n+21 |
 小明和小芳为了测定空气的组成,按如图进行实验:请你通过实验现象和题中信息,帮助他们完成下面的实验内容:
小明和小芳为了测定空气的组成,按如图进行实验:请你通过实验现象和题中信息,帮助他们完成下面的实验内容: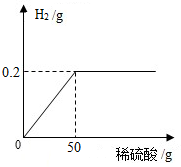 为了定量分析黄铜(铜锌合金)的组成,化学小组进行了如下实验,称取20g黄铜样品放入烧杯中,再缓慢加入适量稀硫酸并不断搅拌,测得生成的氢气与所用稀硫酸的质量关系如图所示.求:
为了定量分析黄铜(铜锌合金)的组成,化学小组进行了如下实验,称取20g黄铜样品放入烧杯中,再缓慢加入适量稀硫酸并不断搅拌,测得生成的氢气与所用稀硫酸的质量关系如图所示.求: