题目内容
16.我国科学家屠呦呦因第一个发现青蒿素(化学式C15H22O5)对疟疾寄生虫有出色疗效,而分享2015年诺贝尔生理学或医学奖.青蒿素的一个分子是由42个原子构成,其中碳元素的质量分数为63.8%(结果准确到0.1%)分析 根据1个青蒿素分子的构成、化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100,进行分析解答即可.
解答 解:1个青蒿素分子是由15个碳原子、22 个氢原子和5个氧原子构成的,则一个青蒿素分子中含有42个原子.
其中碳元素的质量分数为$\frac{12×15}{12×15+1×22+16×5}×$100%≈63.8%.
故答案为:42;63.8%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
7.下列对分子、原子的认识,正确的是( )
| A. | 原子是最小的粒子,不可再分 | |
| B. | 原子能构成分子,但不能直接构成物质 | |
| C. | 气体容易压缩,是因为气体分子变小了 | |
| D. | 当品红溶于水时,品红分子和水分子没有变成其它分子 |
4.下列实验现象描述正确的 是( )
| A. | 铁在空气中燃烧,火星四射 | |
| B. | 镁在空气中燃烧,发出耀眼白光 | |
| C. | 氢氧化钠溶液和硫酸铜溶液混合生成紫色沉淀 | |
| D. | 蘸有浓盐酸和浓氨水的小团棉花靠近,两团棉花中间产生白雾 |
11.某微粒的结构示意图如图所示,下列说法正确的是( )


| A. | 该微粒是离子 | B. | 该微粒的核电荷数是6 | ||
| C. | 该微粒最外层有8个电子 | D. | 该微粒核内有8个质子 |
8.溶质的质量分数为10%的氢氧化钠溶液,对其意义理解不正确的是( )
| A. | 10g溶液中含有1g氢氧化钠 | |
| B. | 100g水中溶解有10g氢氧化钠 | |
| C. | 溶液中溶质质量与溶剂质量的比为1:9 | |
| D. | 5g氢氧化钠固体完全溶解在45g水中,可制成10%的氢氧化钠溶液 |
5.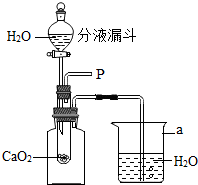 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如右图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是氧气.由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是补充鱼塘中的氧气,仪器a的名称是烧杯.
(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物.开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH)2.请解释小强否定原假设建立新假设的理由:在水较多的环境中即使生成CaO,也会和水作用生成Ca(OH)2.
请设计一个实验方案来验证小强的新假设,并填入如表空格中:
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学方程式:2CaO2+2H2O=2Ca(OH)2+O2↑.
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论CaO2与H2O的反应是放热反应.
 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如右图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是氧气.由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是补充鱼塘中的氧气,仪器a的名称是烧杯.
(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物.开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH)2.请解释小强否定原假设建立新假设的理由:在水较多的环境中即使生成CaO,也会和水作用生成Ca(OH)2.
请设计一个实验方案来验证小强的新假设,并填入如表空格中:
| 实验步骤 | 可能出现的现象 | 结论 |
| 取反应后所得的溶液样品滴入酚酞指示剂(或通入CO2 气体) | 变红(或产生白色浑浊) | CaO2与H2O反应有Ca(OH)2生成 |
| / | CaO2与H2O反应无Ca(OH)2生成 |
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论CaO2与H2O的反应是放热反应.
