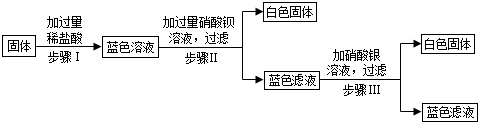
题目内容
8.金属冶炼就是把化合态变成游离态的过程,为了得到金属单质,某兴趣小组成员设想利用H2把自然界中CuO和Fe2O3混合物中的Cu和Fe冶炼出来,取100克该混合物,其中氧的质量分数为16%,用H2充分反应后最多能得H2O的质量是( )| A. | 16克 | B. | 9克 | C. | 36克 | D. | 18克 |
分析 根据题意计算出混合物中氧元素的质量和水中O中氧的质量分数,氧元素全部转化成水,然后根据质量守恒定律,可计算出氧元素全部转化成水的质量.
解答 解:根据题意混合物中氧元素的质量=100×16%=16g,反应中氧元素全部转化成水,根据质量守恒定律16g氧元素全部转化成水的质量=16÷($\frac{16}{18}$×100%)=18g.
故选D.
点评 此题难度不大,掌握反应中氧元素守恒是解题的关键所在.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
14.一种焰火火药中所含的硝酸铜在燃放时产生绿色火焰,发生如下反应:“2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+O2↑+4X↑”.下列有关说法错误的是( )
| A. | 根据质量守恒可知X的化学式为NO2 | B. | 该反应的基本反应类型为分解反应 | ||
| C. | Cu(NO3)2中铜元素的化合价为+1 | D. | 产物中CuO属于氧化物 |
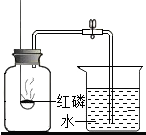 “空气中氧气含量的测定”有多种方法.甲生设计了如图如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题: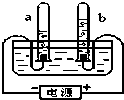 如图是电解水的装置.试回答下列问题:通电后电极上产生气泡,并汇集到试管上端.正极产生的气体是氧气,若负极产生气体的体积为10ml,则正极产生气体的体积为5ml;该实验说明水是由氢元素和氧元素 组成,电解
如图是电解水的装置.试回答下列问题:通电后电极上产生气泡,并汇集到试管上端.正极产生的气体是氧气,若负极产生气体的体积为10ml,则正极产生气体的体积为5ml;该实验说明水是由氢元素和氧元素 组成,电解