题目内容
12.我国首部《食品安全法》于2009年6月1日起颁布.下列能保证食品安全的是( )| A. | 用亚硝酸钠来保鲜豆芽 | B. | 用甲醛溶液浸泡海产品 | ||
| C. | 用小苏打作发酵粉焙制糕点 | D. | 用工业石蜡给水果上蜡“美容” |
分析 A、根据亚硝酸钠是致癌物质分析判断.
B、根据甲醛能破坏蛋白质结构的性质分析判断.
C、根据碳酸氢钠的化学性质分析判断.
D、根据工业石蜡含有有害物质分析判断.
解答 解:A、亚硝酸钠有毒,不能做食品保鲜剂,故A错误.
B、甲醛有毒,能破坏蛋白质的结构,不但对人体有害,而且降低了食品的质量,所以不能用甲醛溶液浸泡海产品,故B错误.
C、碳酸氢钠能与面粉发酵产生的酸反应生成二氧化碳气体,也能受热分解产生二氧化碳气体,使食品疏松多孔,故C正确.
D、工业石蜡含有非常强的致癌物,人体摄入石蜡后,还会造成腹泻等肠胃疾病,故D错误.
故选C.
点评 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 淀粉遇加碘食盐溶液会变蓝 | |
| B. | 瘦肉中主要含蛋白质,不含无机盐之类的营养素 | |
| C. | 某气体能使灼热的氧化铜还原成铜,这种气体一定是一氧化碳 | |
| D. | 鉴别氢氧化钠固体和硝酸铵固体,可加适量水溶解,用手触摸试管外壁温度的变化 |
3.我区某校九年级(1)班的同学们学习“中和反应”后,在实验室里他们将一定量的稀硫酸滴到氢氧化钠溶液中,如图1所示,其反应的化学方程式为H2SO4+2NaOH═Na2SO4+2H2O.
同学们发现该实验观察不到明显的现象,于是进行了一系列探究活动: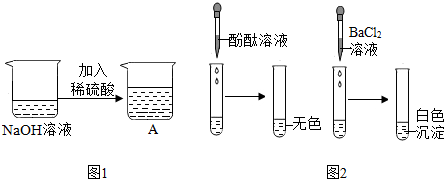
【提出问题】如何验证该反应已经发生?
【实验探究】甲组同学分别取图1所示A烧杯中的溶液进行了两个探究活动(实验1和实验2),现象如图2所示.
【反思评价】甲组同学认为图2中“实验1”能验证反应已经发生了,他们的理由是加入酚酞试液不变色.
【再次提问】图1所示A烧杯中溶液的溶质成分有哪些?
【再次探究】乙组同学进行如下实验,已知他们所加入试剂的类别不同于“实验1”和“实验2”所加试剂的类别.请填空:
【解释与结论】
将“实验2”中烧杯静置一段时间后,上层清液中一定有的溶质是NaCl.(填化学式)
同学们发现该实验观察不到明显的现象,于是进行了一系列探究活动:

【提出问题】如何验证该反应已经发生?
【实验探究】甲组同学分别取图1所示A烧杯中的溶液进行了两个探究活动(实验1和实验2),现象如图2所示.
【反思评价】甲组同学认为图2中“实验1”能验证反应已经发生了,他们的理由是加入酚酞试液不变色.
【再次提问】图1所示A烧杯中溶液的溶质成分有哪些?
【再次探究】乙组同学进行如下实验,已知他们所加入试剂的类别不同于“实验1”和“实验2”所加试剂的类别.请填空:
| 实验操作 | 实验现象 | 结论 |
| 取A烧杯中的少量溶液于试管中,加入铁粉. | 观察到有气泡产生 | A烧杯中溶液的溶质是Na2SO4和H2SO4. |
将“实验2”中烧杯静置一段时间后,上层清液中一定有的溶质是NaCl.(填化学式)
20.化学兴趣小组的同学在老师的指导下,开展如下探究活动.
探究一:A、B、C、D分别是纯碱、烧碱、氯化钠、硫酸钠中的一种,它们之间的转化关系如图1所示.
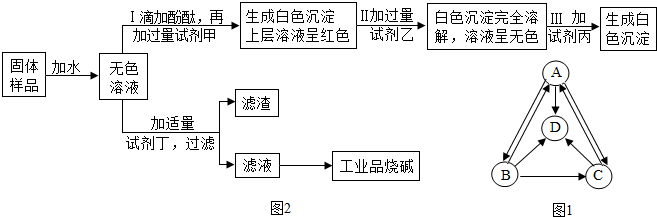
(1)四种物质中,属于碱的是NaOH(填化学式,下同).
(2)物质B是Na2CO3.
探究二:工业品烧碱含有少量氯化钠杂质.该小组同学从一瓶久置的工业品烧碱样品中取出一定量,在烧杯中加适量水溶解后得到样品溶液.用稀硫酸与样品溶液做中和反应实验.有关实验操作和现象如下:
该小组同学对于实验所得红色溶液很感兴趣,展开讨论.溶液里的中和反应是否已经完成?一部分同学认为还没有完成,理由是操作Ⅱ后“溶液仍呈红色”;而另一部分同学则认为中和反应已经完成.结果经过师生共同讨论,确认溶液里中和反应已经完成.
(3)样品溶液的pH>7(填写“<、=或>”).
(4)确认溶液里中和反应已经完成所依据的现象是滴加一定量稀硫酸后溶液中开始产生气泡.
最后,他们设计一个实验方案,验证了久置的工业品烧碱样品中确实含有氯化钠杂质且已经部分变质,并提纯工业品烧碱.其实验流程及部分实验现象如图2所示.
(5)试剂甲和试剂乙的溶液中阴离子都是NO3-(填离子符号).
(6)试剂丁是Ca(OH)2(填化学式).
(7)证明工业品烧碱样品已经部分变质的证据是操作中加过量Ba(NO3)2后生成白色沉淀,上层清液仍呈红色.
探究一:A、B、C、D分别是纯碱、烧碱、氯化钠、硫酸钠中的一种,它们之间的转化关系如图1所示.

(1)四种物质中,属于碱的是NaOH(填化学式,下同).
(2)物质B是Na2CO3.
探究二:工业品烧碱含有少量氯化钠杂质.该小组同学从一瓶久置的工业品烧碱样品中取出一定量,在烧杯中加适量水溶解后得到样品溶液.用稀硫酸与样品溶液做中和反应实验.有关实验操作和现象如下:
| 实验步骤 | 实验现象 |
| Ⅰ.向样品溶液中滴加酚酞溶液 | 溶液呈红色 |
| Ⅱ.向样品溶液中滴加稀硫酸, 并用玻璃棒搅拌 | 滴加一定量稀硫酸后溶液中开始产生气泡 溶液仍呈红色 |
(3)样品溶液的pH>7(填写“<、=或>”).
(4)确认溶液里中和反应已经完成所依据的现象是滴加一定量稀硫酸后溶液中开始产生气泡.
最后,他们设计一个实验方案,验证了久置的工业品烧碱样品中确实含有氯化钠杂质且已经部分变质,并提纯工业品烧碱.其实验流程及部分实验现象如图2所示.
(5)试剂甲和试剂乙的溶液中阴离子都是NO3-(填离子符号).
(6)试剂丁是Ca(OH)2(填化学式).
(7)证明工业品烧碱样品已经部分变质的证据是操作中加过量Ba(NO3)2后生成白色沉淀,上层清液仍呈红色.
7.某学习小组对实验中吸收二氧化碳和干燥气体后的碱石灰成分进行探究.
【查阅资料】
①碱石灰是由CaO和NaOH的固体混合而成,通常用来干燥气体和吸收二氧化碳.
②碱性的Na2CO3溶液可以与中性的BaCl2溶液发生复分解反应.
【提出猜想】该碱石灰的主要成分可能含有CaO、NaOH、Na2CO3、CaCO3、Ca(OH)2.
【设计方案、收集证据】
(1)小李同学将少量的碱石灰样品放入烧杯中,加入足量蒸馏水充分搅拌,静置后烧杯底部有白色沉淀,小李同学认为样品中一定含有CaCO3,小红同学认为他的结论不准确,原因是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH(请用方程式解释).(2)小红同学进一步设计实验并进行验证、过程如下:
【解释与评价】通过小红同学的实验操作①、②,过滤后滴加无色酚酞无明显现象的溶液中一定含有的物质是NaCl、BaCl2.
【查阅资料】
①碱石灰是由CaO和NaOH的固体混合而成,通常用来干燥气体和吸收二氧化碳.
②碱性的Na2CO3溶液可以与中性的BaCl2溶液发生复分解反应.
【提出猜想】该碱石灰的主要成分可能含有CaO、NaOH、Na2CO3、CaCO3、Ca(OH)2.
【设计方案、收集证据】
(1)小李同学将少量的碱石灰样品放入烧杯中,加入足量蒸馏水充分搅拌,静置后烧杯底部有白色沉淀,小李同学认为样品中一定含有CaCO3,小红同学认为他的结论不准确,原因是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH(请用方程式解释).(2)小红同学进一步设计实验并进行验证、过程如下:
| 实验操作 | 实验现象 | 实验结论 |
| ①从小李同学实验的烧杯中取少量上层清夜于试管中,向其中滴加足量BaCl2溶液 | 有白色沉淀生成 | 生成白色沉淀的化学方程式 BaCl2+Na2CO3═BaCO3↓+2NaCl样品中一定含有 Na2CO3 |
| ②过滤,向滤液中滴加无色酚酞溶液 | 无明显现象 | 通过实验及分析,样品中一定不含有 CaO、NaOH、Ca(OH)2 |
2.水是生命之源,下列有关水的说法错误的是( )
| A. | 水是一种重要的溶剂 | |
| B. | 用肥皂水可以区分硬水和软水 | |
| C. | 生活污水毫无用处 | |
| D. | 生活中可以用煮沸的方法降低水的硬度 |
 2012年4月15日,央视《每周质量报告》报道了部分药品生产企业使用铬超标胶囊生产药品的问题.铬虽然是人体必需的一种微量元素,但过量的摄入会对人体造成危害,影响人体的抗氧化系统,溶液得糖尿病、高血压、肿瘤等多种疾病.请回答下列问题:
2012年4月15日,央视《每周质量报告》报道了部分药品生产企业使用铬超标胶囊生产药品的问题.铬虽然是人体必需的一种微量元素,但过量的摄入会对人体造成危害,影响人体的抗氧化系统,溶液得糖尿病、高血压、肿瘤等多种疾病.请回答下列问题: