题目内容
2.现有A、B、C、D、E五瓶无色溶液,它们分别是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠,把它们进行一系列实验,观察到如下现象:①B跟C两溶液混合,产生白色沉淀;②B跟D两溶液混合,产生白色沉淀;③B跟E两溶液混合,产生气泡;④C溶液能使无色酚酞试液变红.分析上述实验现象,推出A、B、C、D、E的化学式分别是NaCl、Na2CO3、Ca(OH)2、CaCl2、HCl.分析 根据A、B、C、D、E五瓶无色溶液,分别是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠,盐酸会与氢氧化钙反应没有明显现象,会与碳酸钠反应生成二氧化碳气体,氯化钠不会与其余的四种物质反应,氯化钙会与碳酸钠反应生成碳酸钙沉淀,氢氧化钙会与碳酸钠反应生成碳酸钙沉淀,碳酸钠、氢氧化钙溶液显碱性等知识进行分析.
解答 解:A、B、C、D、E五瓶无色溶液,分别是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠,盐酸会与氢氧化钙反应没有明显现象,会与碳酸钠反应生成二氧化碳气体,氯化钠不会与其余的四种物质反应,氯化钙会与碳酸钠反应生成碳酸钙沉淀,氢氧化钙会与碳酸钠反应生成碳酸钙沉淀,碳酸钠、氢氧化钙溶液显碱性,B跟E两溶液混合,产生气泡,所以B、E是碳酸钠和盐酸中的一种,B跟C两溶液混合,产生白色沉淀,C溶液能使无色酚酞试液变红,所以B是碳酸钠,C是氢氧化钙,E是盐酸,B跟D两溶液混合,产生白色沉淀,所以D是氯化钙,A是氯化钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀,碳酸钠和盐酸反应生成二氧化碳气体,氢氧化钙显碱性,推导正确,所以A是NaCl,B是Na2CO3,C是Ca(OH)2,D是CaCl2,E是HCl.
故答案为:NaCl,Na2CO3,Ca(OH)2,CaCl2,HCl.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
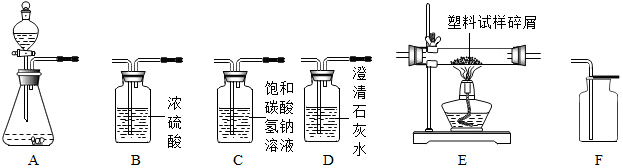
12.根据如图中的实验装置,回答问题:
(1)仪器“a”的名称是锥形瓶.
(2)实验室用加热高锰酸钾制取氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,,发生装置是A(填字母序号,下同).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,收集装置是D,选择该装置进行收集的理由是二氧化碳能溶于水,密度大于空气密度;若二氧化碳中混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从 F 装置的② 端口(填“①”或“②”)通入.
| 发生装置 | 收集装置 | 洗气装置 |
 |  |  |
(2)实验室用加热高锰酸钾制取氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,,发生装置是A(填字母序号,下同).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,收集装置是D,选择该装置进行收集的理由是二氧化碳能溶于水,密度大于空气密度;若二氧化碳中混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从 F 装置的② 端口(填“①”或“②”)通入.
10.有X、Y、Z三种金属,只有Y在自然界主要以单质形式存在,如果把X放入Z的硝酸盐溶液中,X表面有Z析出,据此判断这三种金属的活动性由强到弱顺序为( )
| A. | X>Y>Z | B. | Z>X>Y | C. | Y>Z>X | D. | X>Z>Y |
17.下列各组实验,不能说明镁和铁的金属活动性强弱的是( )
| A. | 铁丝插入硫酸镁溶液中 | |
| B. | 镁粉和铁片插入稀硫酸中,前者速度快 | |
| C. | 镁片插入硫酸亚铁溶液 | |
| D. | 镁片和铁粉插入稀硫酸中,前者速度快 |

 某同学对蜡烛及其燃烧进行了如下探究.请填写下列空格.
某同学对蜡烛及其燃烧进行了如下探究.请填写下列空格.