题目内容
13.南南同学看到“好想你”红枣袋中装有一袋防腐剂,品名为“504双吸剂”,其标签如图1所示.南南和北北对这包久置的“504双吸剂”固体样品很好奇,设计如图2所示实验进行探究.
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究】
南南同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3. |
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是增大接触面积,使反应充分.
(2)步骤②中固体溶解时放出大量热,由此可以判断固体中一定含有CaO.
(3)步骤③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
北北同学对滤渣B又进行探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水 | ①固体减少,有气泡冒出,溶液变为黄色 ②该溶液变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
【实验拓展】为增强双吸剂的吸收效果,常在双吸剂中加入一定量的NaCl,NaCl的作用可能是加快双吸剂中铁粉吸收O2的速率.
分析 [实验探究]
本题探究了防腐剂的成分,取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,配平即可;
对滤渣B又进行探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.
[实验拓展]根据加快铁生锈的方法分析
解答 解:南南同学的方案:取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁.
(1)步骤①样品用磁铁吸引前需经过研碎,研碎的目的是 增大接触面积,使反应充分
(2)由北北同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;
(3)滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
对滤渣B的探究:①根据实验结论,固体中一定含有碳酸钙和氧化铁,因此取滤渣B于试管中,加入适量稀盐酸;②将生成的气体通入澄清石灰水,可看到固体减少,有气泡冒出,溶液变为黄色,澄清石灰水变浑浊;
[实验拓展]铁在盐的环境中生锈速度加快,因此为增强双吸剂的吸收效果,常在双吸剂中加入一定量的NaCl,NaCl的作用可能是 加快双吸剂中铁粉吸收O2的速率(或加快铁锈蚀的速率)
故答案为:南南同学的方案:稀盐酸 Fe
北北同学:(1)增大接触面积,使反应充分 (2)CaO;(3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
对滤渣B的探究
| 实验操作 | 实验现象 | 实验结论 |
| 澄清石灰水. | 有气泡冒出,溶液变为黄色. |
点评 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  实验室制取二氧化碳 | B. |  盖灭酒精灯 | ||
| C. |  实验室制取氧气 | D. |  过滤 |
【查阅资料】
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X;则X的化学式为NH3.
【问题探究】
(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O;
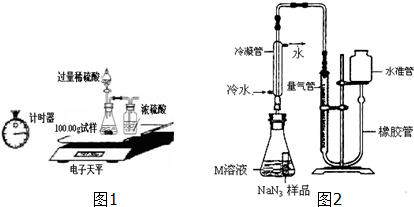
(2)某同学设计如图1装置测出碳酸钠的质量分数,其实验数据记录如下:
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
②若无浓硫酸的洗气装置,会使测定的结果偏大(填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为5.3%.
【问题探究】
(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140g NaN3样品,设计如图2装置测定其质量分数.
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好.
(2)使用冷水冷凝的目的是:使水蒸气液化.
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应. 常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是A(填字母序号).
A.100mL B.1L C.2L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%).
| A. | 冰雪融化 食物腐烂 | B. | 牛奶变酸 铁生锈 | ||
| C. | 水的电解 纸张燃烧 | D. | 酒精挥发 工业上制氧气 |
| A. | 因为通常情况下二氧化碳密度大于空气,故能用向上排空气法收集 | |
| B. | 因为碳酸钙和盐酸在常温下即可迅速反应,故气体发生装置不需要加热 | |
| C. | 因为二氧化碳能溶于水,故不能用排水法收集 | |
| D. | 在发生装置中加入块状石灰石和稀硫酸 |
 如图可用来表示C、CO、CO2、CaCO3四种物质间的相互转化关系,分析回答问题
如图可用来表示C、CO、CO2、CaCO3四种物质间的相互转化关系,分析回答问题 淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义.某小组针对这一现状提出问题,并在实验室进行了以下探究.
淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义.某小组针对这一现状提出问题,并在实验室进行了以下探究.