题目内容
19.下列叙述不正确的是( )| A. | pH=7的溶液是中性溶液 | B. | 用食醋除去水壶中的水垢 | ||
| C. | 用稀盐酸除去铁制品上的锈 | D. | 酸雨就是指呈酸性的雨水 |
分析 A、当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性.
B、根据水垢的主要成分是碳酸钙,进行分析判断.
C、铁制品上的锈的主要成分是氧化铁,能与酸反应,进行分析判断.
D、酸雨是指溶液pH小于5.6的雨水.
解答 解:A、pH=7的溶液是中性溶液,故选项说法正确.
B、水垢的主要成分是碳酸钙,能与酸反应,可用食醋除去水壶中的水垢,故选项说法正确.
C、铁制品上的锈的主要成分是氧化铁,能与酸反应,可用稀盐酸除去铁制品上的锈,故选项说法正确.
D、正常雨水的pH约为5.6,酸雨是指溶液pH小于5.6的雨水,故选项说法错误.
故选:D.
点评 本题难度不大,掌握溶液的酸碱性和溶液pH大小之间的关系、盐的化学性质、酸的化学性质、酸雨等是正确解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.反应2KMnO4+□X+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O,则下列说法正确的是( )
| A. | 该反应中,X前的化学计量系数为10 | |
| B. | X中所含元素的质量比为1:16 | |
| C. | 反应前后所有元素的化合价都变化了 | |
| D. | 该实验发生装置与实验室用高锰酸钾制氧气的发生装置相同 |
8.除去下列物质中所含的杂质,选用的试剂及方法均正确的是( )
| 选项 | 物质 | 杂质 | 试剂 | 方法 |
| A | CO2 | H2O(蒸汽) | NaOH固体 | 干燥 |
| B | KCl粉末 | KClO3 | 少量MnO2 | 加热 |
| C | NaNO3溶液 | NaCl | 过量AgNO3溶液 | 过滤 |
| D | FeCl2溶液 | CuCl2 | 过量Fe粉 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
 如图是 A、B、C三种物质的溶解度曲线.请回答:
如图是 A、B、C三种物质的溶解度曲线.请回答:
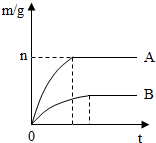 取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.
取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.