题目内容
9.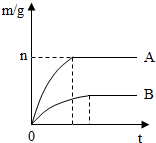 取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.
取等质量的镁、铁两种金属,分别投入两个各装有50mL盐酸的烧杯中.反应产生氢气的质量(m)与反应时间(t)的关系如图所示.反应结束后,无固体剩余.(1)根据图象可推知,两个反应中消耗的盐酸的质量不相等(填“相等”或“不相等”).
(2)小李同学认为,结合图象以及下述两个理由中的任意一个,都可以确定曲线A代表金属镁与盐酸之间的反应.
理由一、等质量的镁、铁与盐酸完全反应,镁与盐酸反应将产生更多的氢气.
理由二、镁与盐酸反应的速度快.
(3)已知,图象中n对应的值为0.4,则两种金属的质量是多少?
(已知:Mg+2HCl=MgCl2+H2↑)
分析 根据金属和酸溶液反应的图象可以得出:①得到的氢气的多少②金属的活动性强弱:反应过程需要的时间越短说明该金属的活动性越强.根据氢气的质量,利用反应的方程式求出镁的质量,则得到铁的质量.
解答 解:(1)根据图象可推知,两者产生氢气不相等,故两个反应中消耗的盐酸的质量不相等;
(2)从图象中不难看出,金属A的反应需要的时间短,说明金属A的反应速率快,即金属A的金属活动性强,金属A为镁;镁与铁相比,镁的金属性比铁强且相同质量的金属完全反应镁生成的氢气比锌多;
(3)设需要镁的质量为x
Mg+HCl=MgC2l+H2↑
24 2
x 0.4g
$\frac{24}{x}=\frac{2}{0.4g}$
x=4.8g,镁、铁两种金属质量相等,铁的质量为4.8g;
答案:
(1)不相等;
(2)镁与盐酸反应的速度快;
(3)金属铁的质量是4.8g.
点评 主要考查了金属和酸溶液的反应的图象从中可以得到什么样的信息,从而培养学生分析问题、解决问题的能力,加强学生对金属活动性顺序的理解.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
19.下列叙述不正确的是( )
| A. | pH=7的溶液是中性溶液 | B. | 用食醋除去水壶中的水垢 | ||
| C. | 用稀盐酸除去铁制品上的锈 | D. | 酸雨就是指呈酸性的雨水 |
17.下列物质的用途由其化学性质决定的是( )
| A. | 用生铁制铁锅 | B. | 用熟石灰降低土壤酸性 | ||
| C. | 用氦气填充气球 | D. | 用16%的食盐溶液选种 |
4.下列有关氧气的认识中,正确的是( )
| A. | 氧气变成液态氧发生化学变化 | B. | 可用带火星的木条检验氧气 | ||
| C. | 可燃物接触氧气就能燃烧 | D. | 供人体呼吸的氧气越纯越好 |
14. 甲、乙、丙、丁四种金属相互转化关系如下图所示,其中金属活动性最弱的是( )
甲、乙、丙、丁四种金属相互转化关系如下图所示,其中金属活动性最弱的是( )
 甲、乙、丙、丁四种金属相互转化关系如下图所示,其中金属活动性最弱的是( )
甲、乙、丙、丁四种金属相互转化关系如下图所示,其中金属活动性最弱的是( )| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
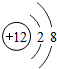 (2)三个水分子3H2O
(2)三个水分子3H2O
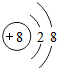 ,并写出离子符号O2-.
,并写出离子符号O2-.