题目内容
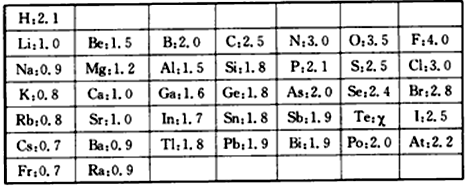
5.核电荷数为1~18的元素原子结构示意图等信息如下,
回答下列问题:
(1)氧元素与硫元素化学性质相似,主要是因为氧元素和硫元素最外层电子数都是6;
(2)写出由8号,13号元素组成的化合物的化学式Al2O3;
(3)表中不同种元素最本质的区别是质子数不同;
(4)几年前,科学家宣布已人工合成了第116号元素,则此元素的核电荷数为116;
(5)从上表中我们还可以探究出以下规律:
①原子序数与原子核电荷数在数值上相等;②同周期元素原子的电子层数相同;③同一族元素原子最外层电子数相同(任写二点)
分析 (1)决定元素化学性质的是最外层电子数;
(2)根据化学式的书写方法:正价在前负价在后,十字交叉再约简;
(3)根据不同种元素最本质的区别是质子数不同,进行解答.
(4)原子序数=核电荷数=质子数;
(5)从原子的结构示意图的理解入手.比较每一横行(即周期)、每一纵行(即族)的电子层和最外层电子数的递变规律来解答.
解答 解:(1)由于氧元素和硫元素最外层电子数都是6,所以化学性质相似;故填:氧元素和硫元素最外层电子数都是6;
(2)8号是氧元素化合价是-2价,13号元素是铝,化合价是+3价,所以化学式是Al2O3.故填:Al2O3;
(3)根据不同种元素最本质的区别是质子数不同,故填:质子数不同;
(4)原子序数=核电荷数=质子数;故填:116;
(5)分析上表可知:
①原子序数与元素原子核电荷数在数值上相等;
②同周期元素原子的电子层数相同;
③同周期元素原子的电子层数相同;
④随着核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化;
故答案为:②同周期元素原子的电子层数相同;③同一族元素原子最外层电子数相同或随着核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化.
点评 元素周期表是我们学习化学的重要工具,我们要了解元素性质呈周期性变化的规律,会运用元素周期表进行解题.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
15.在空气中,物质发生燃烧与油罐遇明火爆炸,它们的共同点有( )
①都产生热量
②都要发光、发热
③都属于氧化反应
④都很缓慢
⑤都需要物质与氧气接触.
①都产生热量
②都要发光、发热
③都属于氧化反应
④都很缓慢
⑤都需要物质与氧气接触.
| A. | ①②③ | B. | ①③⑤ | C. | ②④ | D. | ④⑤ |
16.锶元素的原子结构示意图和在元素周期表中显示的信息见图.下列说法正确的是( )
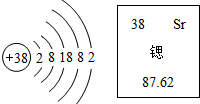

| A. | 锶的相对原子质量是87.62g | |
| B. | 锶原子的中子数为38 | |
| C. | 锶离子的核外电子数是36,形成的锶离子符号是Sr2+ | |
| D. | 从这两张图中能得出锶原子的质子数为为87 |
17.乙醇(C2H5OH)俗称酒精,属于可再生能源.关于乙醇的下列说法错误的( )
| A. | 可通过含淀粉类物质发酵、蒸馏而得 | |
| B. | 其燃烧产物能导致酸雨的形成 | |
| C. | 分子中碳、氢、氧的质量分数之比为12:3:8 | |
| D. | 一种良好的有机溶剂,可溶解脂肪 |
 如图是实验室中过滤操作示意图.回答下列问题:
如图是实验室中过滤操作示意图.回答下列问题: