题目内容
12.实验室配制100g10%的氯化钠溶液,有关实验操作不正确的是( )| A. | 用托盘天平称取10.0g氯化钠 | |
| B. | 用100mL量筒量取90.0mL 水 | |
| C. | 将称取的氯化钠倒入量筒中搅拌溶解 | |
| D. | 将配制好的溶液装入试剂瓶中,贴上标签 |
分析 利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量;结合配制溶质质量分数一定的溶液的基本步骤,进行分析判断.
解答 解:A、溶质质量=溶液质量×溶质的质量分数,配制100g10%的氯化钠溶液,需氯化钠的质量=100g×10%=10.0g,故选项说法正确.
B、溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-10.0g=90.0g(90.0mL),应用100mL量筒量取90.0mL水,故选项说法正确.
C、将称取的氯化钠倒入烧杯中搅拌溶解,不能在量筒内进行溶解,故选项说法错误.
D、将配制好的溶液装入试剂瓶中,贴上标签,故选项说法正确.
故选:C.
点评 本题难度不大,掌握配制溶质质量分数一定的溶液的基本步骤、注意事项等是正确解答本题的关键.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
1. 如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
 如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )| A. | 该实验是将稀硫酸滴入氢氧化钠溶液中 | |
| B. | 曲线上A点的溶液里溶质有H2SO4、Na2SO4和NaOH | |
| C. | 取曲线上M点的溶液,向其中滴入无色酚酞试液,溶液变红色 | |
| D. | 曲线上B点的溶液里溶质有两种 |
18.碳酸钠和碳酸氢钠是生活中常见的盐.通过实验验证、探究它们的化学性质.
【查阅资料】
①Na2CO3+CaCl2=CaCO3↓+2NaCl
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
③Ca(HCO3)2易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
【进行实验】
【解释与结论】
(1)实验1中,NaHCO3与盐酸反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(2)实验2中,试剂a为澄清的石灰水.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2=CaCO3↓+2NaCl+CO2↑+H2O.
【反思与评价】
(1)实验2中,加热NaHCO3后,试管I中残留固体成分可能为Na2CO3;Na2CO3,NaHCO3(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊,未观察到气泡,原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡.
(3)用2中不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3.②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
【查阅资料】
①Na2CO3+CaCl2=CaCO3↓+2NaCl
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
③Ca(HCO3)2易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
| NaHCO3 | Na2CO3 | ||||
| 0.1% | 1% | 5% | 0.1% | ||
| CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
| 1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
| 5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
| 序号 | 实验装置 | 主要实验步骤 | 实验现象 |
| 实验1 |  | 向2支试管中分别加入少量Na2CO3和NaHCO3溶液,再分别滴加盐酸 | 2支试管中均有气泡产生 |
| 实验2 | 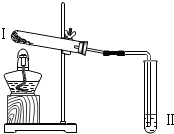 | 向II中加入试剂a,向I中加入少量Na2CO3或NaHCO3固体,分别加热一段时间 | Na2CO3受热时II中无明显现象 NaHCO3受热时II中出现浑浊 |
| 实验3 | 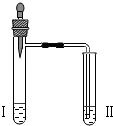 | 向II中加入试剂a,向I中加入少量5%的NaHCO3溶液,再滴加5%的CaCl2溶液 | I中出现浑浊,有气泡产生 II中出现浑浊 |
(1)实验1中,NaHCO3与盐酸反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(2)实验2中,试剂a为澄清的石灰水.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2=CaCO3↓+2NaCl+CO2↑+H2O.
【反思与评价】
(1)实验2中,加热NaHCO3后,试管I中残留固体成分可能为Na2CO3;Na2CO3,NaHCO3(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊,未观察到气泡,原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡.
(3)用2中不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3.②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
1.下列关于分子、原子的说法,正确的是( )
| A. | 原子是最小的微粒,不能再分 | |
| B. | 一个H2O分子中含有一个H2分子 | |
| C. | 当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔 | |
| D. | 分子、原子都可以直接构成物质 |
2.分类法是一种行之有效的科学学习方法.某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系,乙、丙、丁是并列关系.下列各A、B、C、D选项中,正确的是( )
| 选项 | A | B | C | D |
| 甲 | 离子 | 茎 | 氧化反应 | 原子核 |
| 乙、丙、丁 | NH4+、K2MnO4、Na+ | 树皮、韧皮部、木质部 | 呼吸作用、铁生锈、塑料老化 | 质子、电子、中子 |
| A. | A | B. | B | C. | C | D. | D |
 如图一是元素周期表中铁元素的相关信息,图二为某粒子结构示意图.试完成下列问题:
如图一是元素周期表中铁元素的相关信息,图二为某粒子结构示意图.试完成下列问题: