题目内容
8.化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2$\frac{\underline{\;高温高压\;}}{\;}$2NH3.氨气具有可燃性,燃烧时发热量高.近年,科学家发现用催化剂在常温下就能合成氨气,使 其有望成为替代氢能的新一代能源.(1)以上合成氨气的化学反应属于化合反应.
(2)若用如图表示合成氨气的过程,则从反应开始到完成的排列顺序为a→c→b(用字母表示).

(3)氨气燃烧时可能会生成氮氧化物而污染环境,但在一定条件下,氨气燃烧却没有任何污染,该反应原理是 4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2X+6H2O,其中X是N2(填化学式).
(4)如果氨气不慎泄露,防止引发危险,可关闭阀门,严禁明火并喷洒大量水雾.由此可知氨气可能具有的一条性质是易溶于水.
分析 (1)根据反应物、生成物的种类可以判断反应类型;
(2)反应过程中,氮气、氢气分解成氮原子、氢原子,氮原子和氢原子结合成氨分子;
(3)化学反应前后,元素种类不变,原子种类、总个数和质量都不变;
(4)如果氨气不慎泄露,防止引发危险,可关闭阀门,严禁明火并喷洒大量水雾,由此可知氨气可能具有的一条性质是易溶于水.
解答 解:(1)以上合成氨气的化学反应中,反应物是两种,生成物是一种,属于化合反应.
故填:化合.
(2)反应过程中,氮气、氢气分解成氮原子、氢原子,氮原子和氢原子结合成氨分子,则从反应开始到完成的排列顺序为a→c→b.
故填:a→c→b.
(3)由4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2X+6H2O可知,反应前氮原子是4个,反应后应该是4个,包含在2X中,反应前后氢原子都是12个,氧原子都是6个,因此X是N2.
故填:N2.
(4)如果氨气不慎泄露,防止引发危险,可关闭阀门,严禁明火并喷洒大量水雾.由此可知氨气可能具有的一条性质是易溶于水.
故填:易溶于水.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
9.两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是( )
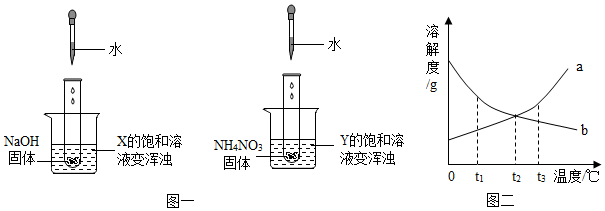

| A. | Y的溶解度曲线为b曲线 | |
| B. | 降温可使X的饱和溶液变浑浊 | |
| C. | X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大 | |
| D. | t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y |
16.盖“浇饭”是上班族的最爱,下列食材制作的“盖浇饭”符合“营养均衡”理念的是( )

| A. | ②③④ | B. | ①③⑤ | C. | ①④⑤ | D. | ①②③ |
3.下列知识归纳有错误的一组是( )
| A.物质组成 | B.物质构成 |
| 高锰酸钾、锰酸钾-组成元素相同 由一种元素组成的纯净物-单质 | 质子数-决定元素的种类 最外层电子数-决定元素的化学性质 |
| C.物质性质 | D.物质变化 |
| CO和CO2-都具有还原性 镁、铝、锌、铁-都能与稀盐酸反应 | 氢氧化钠去油污-化学变化 洗洁精去油污-物理变化 |
| A. | A | B. | B | C. | C | D. | D |

 安徽合肥地铁1号线12月26日正式开通运营,这也标志着.合肥市民将迎来“地铁生活”,改变出现方式.如图是合肥地铁图:
安徽合肥地铁1号线12月26日正式开通运营,这也标志着.合肥市民将迎来“地铁生活”,改变出现方式.如图是合肥地铁图: