题目内容
8.下列叙述正确的是( )| A. | pH为零的溶液既不显示酸性又不显示碱性 | |
| B. | 打开盛浓硫酸的试剂瓶塞,就可以看到白雾 | |
| C. | 把锌粒投入装有稀硫酸的试管中,试管壁发烫,说明金属与酸的反应是放热反应 | |
| D. | 能使紫色石蕊试液变红的溶液是酸性溶液 |
分析 A、根据pH小于7的溶液显酸性进行解答;
B、根据浓硫酸能够吸收水蒸气,不容易挥发进行解答;
C、根据金属与酸反应放热分析;
D、根据显酸性的溶液能使石蕊试液变红色进行解答;
解答 解:A、pH为零的溶液显酸性.故选项错误;
B、打开盛浓硫酸的试剂瓶塞,不能产生白雾.故选项错误;
C、金属与酸反应是放热反应.故选项错正确;
D、能使紫色石蕊试液变红的溶液是酸性溶液.故选项错正确;
故选CD.
点评 解答本题要理解pH为零的溶液显酸性,并且酸性很强.

练习册系列答案
相关题目
19.下列关于空气的说法中,错误的是( )
| A. | 空气是一种十分重要的天然资源 | |
| B. | 少量有害气体进入空气中,依靠大自然的自净能力,空气仍能保持洁净 | |
| C. | 空气中的稀有气体一般不跟其他物质反应,曾被称为“惰性气体” | |
| D. | 按质量计算,空气中约含氮气78%,氧气21%,其他气体和杂质约占1% |
9.某混合气体可能含有一氧化碳、氢气及少量的二氧化碳和水蒸气和甲烷,某兴趣小组为验证混合的成分,设计了如图所示的装置,进行有关的实验探究【提示:假定每步均完全反应或吸收】.请回答有关问题: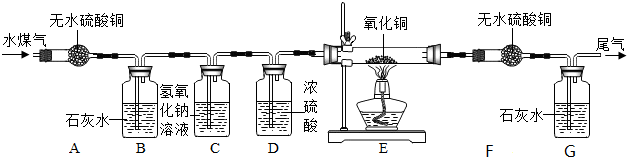
(1)A装置的目的是检验是否含有水.
(2)B中的澄清石灰水变浑浊说明混合气体中含有二氧化碳.
(3)C装置的作用是除去原来的二氧化碳气体.
(4)D装置的作用是除去水蒸气.
(5)同学们对通过D后的可燃气体继续进行探究.若F中无水硫酸铜白色粉末不变蓝,G中的澄清石灰水变浑浊,则可燃气体中一定含有一氧化碳.若F中无水硫酸铜白色粉末变蓝,G中的澄清石灰水不变浑浊,则可燃气体中一定含有甲烷.若F中无水硫酸铜白色粉末变蓝,G中的澄清石灰水变浑浊,请用表中实验数据进行分析,可燃气体的组成有2种.

(1)A装置的目的是检验是否含有水.
(2)B中的澄清石灰水变浑浊说明混合气体中含有二氧化碳.
(3)C装置的作用是除去原来的二氧化碳气体.
(4)D装置的作用是除去水蒸气.
(5)同学们对通过D后的可燃气体继续进行探究.若F中无水硫酸铜白色粉末不变蓝,G中的澄清石灰水变浑浊,则可燃气体中一定含有一氧化碳.若F中无水硫酸铜白色粉末变蓝,G中的澄清石灰水不变浑浊,则可燃气体中一定含有甲烷.若F中无水硫酸铜白色粉末变蓝,G中的澄清石灰水变浑浊,请用表中实验数据进行分析,可燃气体的组成有2种.
| 称量项目 | 反应前 | 反应后 |
| F玻璃管及所盛固体的质量 | 86.3g | 89.9g |
| G洗气瓶和所盛石灰水的质量 | 284.2g | 293.0g |
10.下列物质的用途与其化学性质相关的是( )
| A. | 石墨用作干电池电极 | B. | 氧气用于气焊 | ||
| C. | 金刚石用于刻划玻璃 | D. | 铜用于制作插头 |