题目内容
16. 某造纸厂排放的废水中含有Na2CO3和NaOH,为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次慢慢加入到烧杯中,获得的实验现象和数据如表所示:
某造纸厂排放的废水中含有Na2CO3和NaOH,为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次慢慢加入到烧杯中,获得的实验现象和数据如表所示:| 实验次数 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 10 | 10 | 10 | 10 |
| 生成气体质量(g) | 0 | x | 1.2 | 1.0 |
(1)表中x的值为0;
(2)第2次加入稀盐酸充分反应后,溶液中的溶质是Na2CO3和NaCl(填化学式);
(3)反应产生CO2的质量为2.2g;
(4)计算该废水中Na2CO3的质量分数.
分析 (1)根据消耗盐酸与生成气体之间的关系分析;
(2)根据数据图表可知第2次加入稀盐酸充分反应后,盐酸只与氢氧化钠恰好反应;
(3)根据图象可知生成二氧化碳的质量;同时也可以知道氢氧化钠先与稀盐酸反应(开始没有生成气体),由数据可知每消耗10克的盐酸生成1.2g气体;
(4)根据二氧化碳的质量结合化学方程式进行求解.
解答 解:(1)由表中数据可知,盐酸在加入20克后才有气体产生,所以x为0
(2)根据数据图表可知第2次加入稀盐酸充分反应后,盐酸只与氢氧化钠恰好反应生成氯化钠和水,碳酸钠没有反应,所以第2次加入稀盐酸充分反应后,溶液中的溶质是氯化钠和碳酸钠;
(3)由数据可知每消耗10克的盐酸生成1.2g气体,第4次只生成1.0g气体,说明碳酸钠已经完全反应,盐酸有剩余,所以一共反应产生CO2的质量为1.2g+1.0g=2.2g;
(4)设生成2.2g二氧化碳需要碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
$\frac{106}{x}$=$\frac{44}{2.2g}$
解得x=5.3g
废水中Na2CO3的质量分数:$\frac{5.3g}{50g}$×100%=10.6%;
故答案为:(1)0
(2)Na2CO3和NaCl
(3)2.2g(4)10.6%
点评 此题主要是在纯碱的化学性质的基础上考查质量守恒定律的有关知识,以及混合物中质量分数的计算问题,注重学生综合能力的培养,是中考的考点之一.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.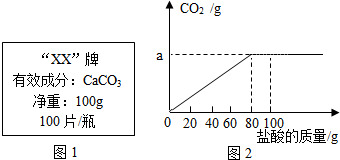 钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
(1)表中m的数值为25;n的数值为20.
(2)该品牌补钙药剂中CaCO3的质量分数是50%;图象中a的数值为8.8.
(3)求该盐酸中溶质的质量分数为(写出计算过程,计算结果保留一位小数)
 钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.(1)表中m的数值为25;n的数值为20.
(2)该品牌补钙药剂中CaCO3的质量分数是50%;图象中a的数值为8.8.
(3)求该盐酸中溶质的质量分数为(写出计算过程,计算结果保留一位小数)
| 第1次 | 第2次 | 第3次 | 第4次 | 第五次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | 30 | m | 20 | n |
7.暑假去植物园游玩,同学们的感觉与科学知识的联系不正确的是( )
| A. | 植物园空气清新,是因为这里氧气的含量高 | |
| B. | 中午坐公园的椅子感觉很烫,是热传递改变了物体的内能 | |
| C. | 人出汗后,微风吹过感到凉爽,是因为汗液蒸发加快,蒸发吸收身体的热量 | |
| D. | 喝可口可乐清热解渴,是因为可口可乐中溶解的二氧化碳汽化吸热 |
1.下列物质属于纯净物的是( )
| A. | 波尔多液 | B. | 浓硫酸 | C. | 液氧 | D. | 加碘盐 |
8.下列各组转化中,一定条件下均能一步实现的组合是( )


| A. | ①② | B. | ①③ | C. | ①②③ | D. | 只有③ |
5. 由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“
由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“ ”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )
”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )
 由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“
由C、H、O三种元素组成的初中常见物质间有如图所示的关系,图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可转化另一物质,“ ”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )
”表示两种物质可以互相转化.在通常情况下,E为液体,其余都是气体.以下判断不正确的是( )| A. | 物质E一定是水 | B. | 物质C属于有机化合物 | ||
| C. | 物质B、F都具有还原性 | D. | 物质D具有可燃性 |
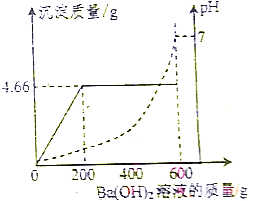 为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴加入某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示.
为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴加入某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示.