题目内容
4.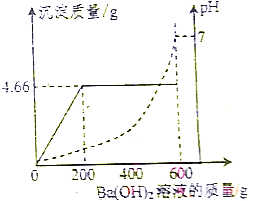 为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴加入某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示.
为测定由盐酸和硫酸组成的某混合酸中溶质的质量分数,取100g该混合酸,逐滴加入某Ba(OH)2溶液,生成沉淀BaSO4的质量和pH的变化关系如图所示.(1)当加入的氢氧化钡溶液为200g时,混合酸恰好被中和.
(2)求Ba(OH)2溶液的溶质质量分数是多少?(写出计算过程)(精确到0.01%)
分析 (1)根据图象中的转折点分析完全反应后生成BaSO4沉淀的质量及加入的氢氧化钡溶液的质量;
(2)根据沉淀的质量利用化学方程式,求出参加反应的加入的氢氧化钡的质量;最后用质量分数公式求溶液中溶质的质量分数.
解答 解:(1)由图示可知,当加入的氢氧化钡溶液为200g时,混合酸恰好被中和;
(2)由图示可知,生成沉淀的最大量为4.66g,
设恰好完全反应时,消耗Ba(OH)2的质量为x,
Ba(OH)2+H2SO4=BaSO4↓+2H2O
171 233
x 4.66g
$\frac{171}{x}=\frac{233}{4.66g}$
x=3.42g
Ba(OH)2溶液的溶质质量分数是$\frac{3.42g}{200g}×$100%=1.71%
答案:
(1)200
(2)Ba(OH)2溶液的溶质质量分数是1.71%.
点评 本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.

练习册系列答案
相关题目
9.在开采自燃煤层时,矿工会在煤矿内残留的煤上喷洒一定浓度的阻化剂溶液,抑制煤的自燃,从而达到较好的防火效果.某科研小组针对不同情况下的煤粉进行了相关测试,得到以下数据(活化能指煤粉达到着火温度后煤粉燃烧所吸收的热量):
请根据以上信息解释喷洒阻化剂溶液能抑制煤自燃的原因.
| 项目 | 无阻化剂 | 喷洒水 | 喷洒阻化剂(MgCl2)溶液 |
| 着火点(℃) | 274.1 | 274.1 | 283.8 |
| 活化能(kJ) | 9.68 | 9.68 | 12.58 |
16. 某造纸厂排放的废水中含有Na2CO3和NaOH,为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次慢慢加入到烧杯中,获得的实验现象和数据如表所示:
某造纸厂排放的废水中含有Na2CO3和NaOH,为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次慢慢加入到烧杯中,获得的实验现象和数据如表所示:
请仔细分析上述数据,回答下列问题:
(1)表中x的值为0;
(2)第2次加入稀盐酸充分反应后,溶液中的溶质是Na2CO3和NaCl(填化学式);
(3)反应产生CO2的质量为2.2g;
(4)计算该废水中Na2CO3的质量分数.
 某造纸厂排放的废水中含有Na2CO3和NaOH,为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次慢慢加入到烧杯中,获得的实验现象和数据如表所示:
某造纸厂排放的废水中含有Na2CO3和NaOH,为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次慢慢加入到烧杯中,获得的实验现象和数据如表所示:| 实验次数 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 10 | 10 | 10 | 10 |
| 生成气体质量(g) | 0 | x | 1.2 | 1.0 |
(1)表中x的值为0;
(2)第2次加入稀盐酸充分反应后,溶液中的溶质是Na2CO3和NaCl(填化学式);
(3)反应产生CO2的质量为2.2g;
(4)计算该废水中Na2CO3的质量分数.
13.图示流程进行“燃煤烟气的脱硫研究”实验中,SO2和O2的混合气体连续通入,水和铁在起始时一次性加入,反应液多次循环.下列说法正确的是( )


| A. | 吸收液的主要成分是H2SO4 | |
| B. | 该流程的研究对减缓“温室效应”有积极的意义 | |
| C. | 反应液可以用来制备FeSO4•7H2O,它在医疗上常用于治疗佝偻病 | |
| D. | 反应液流入Ⅰ中,反应速率明显加快,可能是反应液有催化作用 |
14.“科苏”是一种治疗高血压病的药物.其主要成分是厄贝沙坦,其化学式为C25H28N6O.下列说法错误的是( )
| A. | 厄贝沙坦是一种氧化物 | |
| B. | 厄贝沙坦是一种有机物 | |
| C. | 一个厄贝沙坦分子中碳、氢、氮、氧原子个数比为25:28:6:1 | |
| D. | 厄贝沙坦是由碳、氢、氮、氧四种元素组成的 |

 如图所示,A~E是初中化学常见的物质,图中“→”表示转化关系,“-”表示相互能发生化学反应(部分物质和反应条件未标出),已知B可用于灭火,且与A、E的物质类别相同,D为胃液中的主要成分.
如图所示,A~E是初中化学常见的物质,图中“→”表示转化关系,“-”表示相互能发生化学反应(部分物质和反应条件未标出),已知B可用于灭火,且与A、E的物质类别相同,D为胃液中的主要成分.