题目内容
13.根据如图回答问题.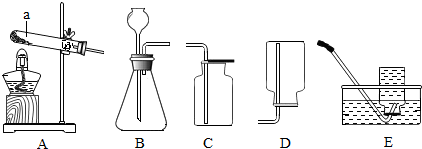
(1)仪器a的名称是试管.
(2)实验室用高锰酸钾制取氧气反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,所选用的发生装置是A(填字母序号,下同),收集装置是C或E.
(3)实验室用装置B、C制取二氧化碳反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.将生成的气体通入紫色石蕊溶液,观察到的现象是紫色石蕊试液变为红色.
分析 (1)据常用仪器名称、用途回答;
(2)据反应原理书写方程式,据反应物状态和反应条件选择发生装置,据气体密度和溶解性选择收集装置;
(3)据反应原理书写方程式,并据二氧化碳可与水反应生成酸,酸性溶液可使紫色石蕊试液变红分析解答.
解答 解:(1)标号仪器是装药品的试管;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,该反应属于固体加热型,故选发生装置A,氧气密度比空气大,所以还可用向上排空气法收集;
(3)实验室制取二氧化碳用大理石或石灰石和稀盐酸常温反应,二者反应生成氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;二氧化碳可与水反应生成碳酸,碳酸可使紫色石蕊试液变红;
故答案为:(1)试管;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;A;C;
(3)CaCO3+2HCl=CaCl2+CO2↑+H2O;紫色石蕊试液变为红色.
点评 据反应物状态和反应条件选择发生装置,据气体密度和溶解性选择收集装置,并结合二氧化碳的性质分析解答,属于基础知识考查题.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
19.下列物质直接由原子构成的是( )
| A. | 铜 | B. | 氧气 | C. | 氯化钠 | D. | 二氧化碳 |
4.一定量的氧气和甲烷反应,测得反应前后各物质的质量如下表,则下列有关说法正确的是( )
| 物质 | 氧气 | 甲烷 | 水 | 二氧化碳 | X |
| 反应前质量/g | 11.2 | 3.2 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 4.4 | 待测 |
| A. | 反应类型属于分解反应 | |
| B. | X中两种元素的质量比为1:1 | |
| C. | 反应后X的质量为3.6g | |
| D. | 反应方程式中氧气与水的化学计量数之比为7:8 |
1.在森林中设防火带的目的是( )
| A. | 隔绝空气 | B. | 降低温度 | C. | 方便运输 | D. | 隔离可燃物 |
18.下列物质中,不属于溶液的是( )
| A. | 矿泉水 | B. | 硬水 | C. | 泥水 | D. | 生理盐水 |
2.体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.
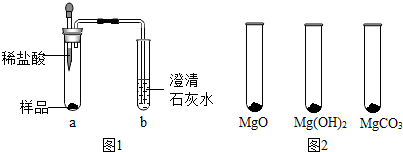
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清的石灰水变浑浊.则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解.此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】“镁粉”不只含有MgCO3.理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.

已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清的石灰水变浑浊.则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
【实验分析及结论】“镁粉”不只含有MgCO3.理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.
3.小刚同学在学习了酶的知识后了解到了酶的催化作用要受到温度、酸碱度(pH)的影响.联系到前面学习的知识,小刚同学又提出了自己的一个猜想:酶的催化作用可能会受到重金属离子的影响.结合猜想小刚进行了如下探究:
【查阅资料】重金属指密度大于5克/厘米3的金属(一般指密度大于4.5克/厘米3的金属).
【设计实验】取试管4支,编号,按表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入碘液3滴,观察其颜色变化.
【实验结论】酶的催化作用要受到重金属离子的影响.
根据小刚同学的探究过程回答下列问题:
(1)小刚同学提出猜想的依据是:酶是一种蛋白质,遇到重金属离子会变性,从而丧失活性.
(2)比较上述实验中的1号和2号试管及观察到的现象,你可得出的结论是:唾液淀粉酶能催化淀粉的分解.
(3)在看了小刚的设计及实验后,同桌的小王认为凭上述实验还不足以证明小刚的猜想.小王提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力.如果你也同小王一起探究,你还可以建议小刚作怎样的更换?将NaCl溶液换成Na2SO4溶液.
(4)在生活中重金属盐类通常也被作为消毒杀菌的药物来使用,如图所示为硝酸银滴眼液的药品说明书的一部分,其中有一条注意事项,你能用所学的科学知识解释:为什么可以用0.9%的生理盐水来减轻硝酸银的腐蚀性?(用化学方程式表示)NaCl+AgNO3=NaNO3+AgCl↓.

(5)随着工业的不断发展,重金属污染越来越严重,重金属中毒事件也越来越常见,因此了解一些必要的急救措施对我们来说很重要.若有人误食被电镀厂废水(含铬(Cr)、镍(Ni)、镉(Cd))污染的食物而急性中毒,为解毒,下列四种供选物质中你不应该选择的是④.
①鸡蛋清 ②鲜豆浆 ③鲜牛奶 ④糖水.
【查阅资料】重金属指密度大于5克/厘米3的金属(一般指密度大于4.5克/厘米3的金属).
【设计实验】取试管4支,编号,按表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入碘液3滴,观察其颜色变化.
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.3%NaCl溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
根据小刚同学的探究过程回答下列问题:
(1)小刚同学提出猜想的依据是:酶是一种蛋白质,遇到重金属离子会变性,从而丧失活性.
(2)比较上述实验中的1号和2号试管及观察到的现象,你可得出的结论是:唾液淀粉酶能催化淀粉的分解.
(3)在看了小刚的设计及实验后,同桌的小王认为凭上述实验还不足以证明小刚的猜想.小王提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力.如果你也同小王一起探究,你还可以建议小刚作怎样的更换?将NaCl溶液换成Na2SO4溶液.
(4)在生活中重金属盐类通常也被作为消毒杀菌的药物来使用,如图所示为硝酸银滴眼液的药品说明书的一部分,其中有一条注意事项,你能用所学的科学知识解释:为什么可以用0.9%的生理盐水来减轻硝酸银的腐蚀性?(用化学方程式表示)NaCl+AgNO3=NaNO3+AgCl↓.

(5)随着工业的不断发展,重金属污染越来越严重,重金属中毒事件也越来越常见,因此了解一些必要的急救措施对我们来说很重要.若有人误食被电镀厂废水(含铬(Cr)、镍(Ni)、镉(Cd))污染的食物而急性中毒,为解毒,下列四种供选物质中你不应该选择的是④.
①鸡蛋清 ②鲜豆浆 ③鲜牛奶 ④糖水.
 能源和环境问题日益成为人们关注的焦点.
能源和环境问题日益成为人们关注的焦点.