题目内容
4.金属资源属于不可再生资源.某同学用同规格且光亮洁净无锈的铁钉进行了如图所示实验.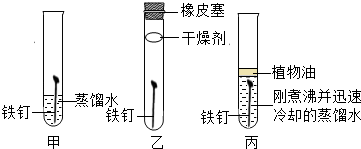
(1)一段时间后,铁钉表面生锈的是甲(填“甲”、“乙”或“丙”);由此可知,铁制品生锈的条件是铁与氧气、水充分接触.
(2)实验丙中为什么要用“刚煮沸并迅速冷却的蒸馏水”?除去水中溶解的氧气,使铁不能与氧气接触.
分析 (1)根据铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,进行分析解答.
(2)根据刚煮沸蒸馏水中不含氧气,进行分析解答.
解答 解:(1)甲中的铁钉能与氧气、水充分接触;乙中的铁钉只能与空气接触;丙中的铁钉只能与水接触;一段时间后,铁钉表面生锈的是甲,说明铁制品生锈的条件是铁与氧气、水充分接触.
(2)实验丙中用“刚煮沸并迅速冷却的蒸馏水”,是因为是刚煮沸蒸馏水中不含氧气,使铁不能与氧气接触.
故答案为:(1)甲;铁与氧气、水充分接触;(2)除去水中溶解的氧气,使铁不能与氧气接触.
点评 本题难度不大,掌握铁锈蚀的条件(铁与氧气、水同时接触)是正确解答本题的关键.

练习册系列答案
相关题目
16. 向氢氧化钠溶液中不断滴入盐酸,得到如图的曲线,下列有关判断不正确的是( )
向氢氧化钠溶液中不断滴入盐酸,得到如图的曲线,下列有关判断不正确的是( )
 向氢氧化钠溶液中不断滴入盐酸,得到如图的曲线,下列有关判断不正确的是( )
向氢氧化钠溶液中不断滴入盐酸,得到如图的曲线,下列有关判断不正确的是( )| A. | a点时溶液中有氢氧化钠和氯化钠 | |
| B. | a点到b点溶液中盐酸的量不断增大 | |
| C. | b 点时,HCl 与NaOH恰好完全反应 | |
| D. | b 点到c点时,溶液中氯化钠的量不再增加 |
17.如表归纳和总结完全正确的一组是( )
| A对鉴别方法的认识 | B对安全的认识 |
| ①区分硬水和软水,加肥皂水后搅拌 ②区分棉纤维和羊毛纤维,点燃后闻气味 ③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 | ①点燃可燃性气体前一定要验纯 ②煤矿矿井要保持通风、严禁烟火 ③海鲜食品喷洒甲醛溶液防腐 |
| C对现象的认识 | D对防锈的认识 |
| ①气体压缩,气体分子之间的间隔变小 ②活性炭除去异味,活性炭具有吸附性 ③喝汽水打嗝,气体溶解度随温度升高而增大 | ①自行车的支架喷油漆防锈 ②菜刀用后及时洗净擦干 ③保留铁锈可防止铁进一步锈蚀 |
| A. | A | B. | B | C. | C | D. | D |
19.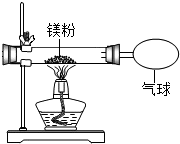 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
(1)请写出镁条与氧气反应的化学方程式2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO.
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律.我不同意(填“同意”或“不同意”)小明的观点,因为所有的化学反应都遵循质量守恒定律.
(3)小红同学按如图所示的装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝.
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
【反思与交流】空气中N2的含量计远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释:氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应.并写镁与氮气反应的化学方程式:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.(1)请写出镁条与氧气反应的化学方程式2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO.
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律.我不同意(填“同意”或“不同意”)小明的观点,因为所有的化学反应都遵循质量守恒定律.
(3)小红同学按如图所示的装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝.
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 | 实验现象 | 结论 |
| 取燃烧后的产物于试管中,加少量水,再将湿润的红色石蕊试纸放在试管口,观察现象. | 试管中有气体产生,湿润的红色石蕊试纸变蓝 | 燃烧产物中含有Mg3N2 |
9.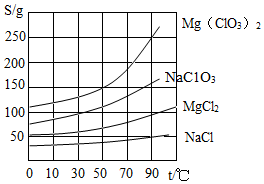 如图是几种物质的溶解度曲线图,下列有关说法中正确的是 ( )
如图是几种物质的溶解度曲线图,下列有关说法中正确的是 ( )
 如图是几种物质的溶解度曲线图,下列有关说法中正确的是 ( )
如图是几种物质的溶解度曲线图,下列有关说法中正确的是 ( )| A. | NaCl的溶解度是50克 | |
| B. | 50℃时四种物质形成的饱和溶液中MgCl2溶液的质量分数最小 | |
| C. | 将等质量的四份饱和溶液由90℃降温至50℃,析出晶体最多的是Mg(ClO3)2 | |
| D. | 将NaC1O3和MgCl2两种饱和溶液混合后无晶体析出.在加热蒸发时开始有晶体析出.此晶体是NaClO3 |
14.下列物质在空气中长时间敞口放置,会变质且质量增加的是( )
| A. | 食盐、浓盐酸 | B. | 生石灰、浓盐酸 | C. | 烧碱、浓硫酸 | D. | 熟石灰、生石灰 |
