题目内容
3.铁是生活中常见的金属.(1)铁制品在潮湿的空气中特别容易生锈(主要成分为Fe2O3),除锈的方法很多,写出盐酸除铁锈的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(2)新型材料纳米级Fe粉具有广泛的用途,它比普通Fe粉更易与氧气反应,其制备工艺流程如下图所示:
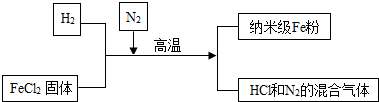
请回答下列问题:
①纳米级Fe粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为Fe3O4.
②请补充完成上述制备工艺的化学方程式:H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
在制备纳米级Fe粉的工艺流程中,N2的作用是保护.
③研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质.
为除去样品中的杂质,在无氧环境下,先加水溶解,然后再过滤、洗涤、烘干.
计算烧碱样品中杂质氯化钠的质量分数(请列出计算过程).
分析 (1)铁锈的主要成分是氧化铁,氧化铁能和稀盐酸反应生成氯化铁和水;
(2)①根据铁与氧气反应生成四氧化三铁考虑;
②根据反应前后各种原子种类和数目不变和氮气化学性质稳定考虑;
③根据铁不溶于水,氯化亚铁溶于水进行混合物的分离.
解答 解:(1)氧化铁能和稀盐酸反应生成氯化铁和水,反应的化学方程式分别为:Fe2O3+6HCl═2FeCl3+3H2O;
(2)①铁在氧气中燃烧生成四氧化三铁,所以黑色固体是四氧化三铁;
②反应物的分子中含有2个氢原子、一个铁原子、2个氯原子,生成物中已经含有一个铁原子,还缺少2个氢原子和2个氯原子,所以补充的内容是2HCl;氮气化学性质稳定,在反应中起保护气的作用;
③铁不溶于水,氯化亚铁溶于水,所以加水溶解,再进行过滤、洗涤干燥即可.
故答案为:(1)Fe2O3+6HCl═2FeCl3+3H2O;
(2)①Fe3O4;
②2HCl;
③水;过滤
点评 解答本题关键是知道铁燃烧的产物是四氧化三铁,能够灵活运用质量守恒定律解决实际问题,知道不溶性固体和液体分离的方法.

练习册系列答案
相关题目
14.废弃的易拉罐和塑料瓶属于( )
| A. | 厨余垃圾 | B. | 可回收垃圾 | C. | 不可回收垃圾 | D. | 有害垃圾 |
18.下列各组离子在水中能大量共存的是( )
| A. | H+、CO32-、Cl- | B. | Na+、Fe3+、OH- | C. | H+、K+、NO3- | D. | K+、Ba2+、SO42- |
8.下列说法错误的是( )
| A. | 人体中缺乏维生素C,会患坏血病 | |
| B. | 炒菜的时候多加油盐,使菜有滋有味 | |
| C. | 用加碘盐作调味剂,可预防大脖子病 | |
| D. | 适量补充FeSO4,可预防缺铁性贫血 |
15.物质P和物质Q在一定条件下可以相互转化(均是一步反应),下列选项不符合题意的是( )
| A. | P是O2 Q是CO2 | B. | P是NaCl Q是NaNO3 | ||
| C. | P是Fe Q是Fe3O4 | D. | P是CO2 Q是CaCO3 |

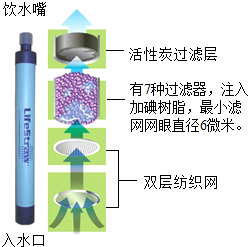 电视节目《荒野求生》中的生命吸管(如图所示)是一种将污水净化为饮用水的吸管装置,可以除去99.3% 的细菌和病毒,但难以除去汞等金属离子.回答下列问题:
电视节目《荒野求生》中的生命吸管(如图所示)是一种将污水净化为饮用水的吸管装置,可以除去99.3% 的细菌和病毒,但难以除去汞等金属离子.回答下列问题:
 如图所示,是A、B、C三种固体物质的溶解度曲线.
如图所示,是A、B、C三种固体物质的溶解度曲线.