题目内容
19.定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法.某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究.请你一起踏上探究之路,回答下列问题.【查阅资料】
①无水CuSO4遇水变蓝;
②高温灼烧CuO生成Cu2O和O2;
③Cu2O与稀H2SO4反应:Cu2O+H2SO4═Cu+CuSO4+H2O,横线上的化学式为CuSO4.
【设计实验方案】
方案1:取该红色固体加入适量稀H2SO4,实验现象为溶液变为蓝色,结论为红色固体中含有Cu2O.
方案2:装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O.
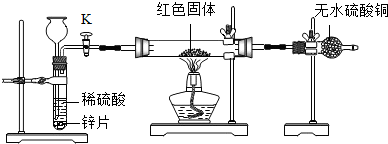
(1)为确保探究的科学、合理、安全,实验中还应采取的措施:
①加热前先排尽装置中的空气;
②在氢气发生器与硬质玻璃管之间加一个干燥装置;
③在盛有CuSO4的干燥管后再连接一个装有碱石灰的干燥管.
(2)由方案2实验后得出结论:红色固体中含有Cu2O.写出红色固体Cu2O与H2反应的化学方程式:H2+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O.
分析 【查阅资料】根据质量守恒定律分析横线上的化学式;
【设计实验方案】
方案1 根据氧化亚铜和硫酸反应生成硫酸铜,硫酸铜溶液呈蓝色进行解答;
方案2
(1)根据水的存在会对实验结果造成影响来回答判断;
(2)根据氢气和氧化亚铜在加热条件下生成铜和水进行解答;
解答 解:【查阅资料】③由质量守恒定律反应前后原子的种类及数目不变可知,横线上的化学式是:CuSO4;
【设计实验方案】
方案1 氧化亚铜和硫酸反应生成硫酸铜,硫酸铜溶液呈蓝色,所以取该红色固体加入适量稀H2SO4,实验现象为溶液变为蓝色,结论为红色固体中含有Cu2O;
方案2
(1)根据硫酸铜是否变蓝判断是否含有氧化亚铜时,要注意水的干扰因素,所以制取的氢气要干燥,可以在氢气发生器与硬质玻璃管之间加一个干燥装置,并且要将空气中的水的干扰排除,可以在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管,实验前要将装置中的空气排净,防止干扰;
(2)氢气和氧化亚铜在加热条件下生成铜和水,反应的化学方程式为:H2+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O.
故答为:【查阅资料】③CuSO4;
【设计实验方案】方案1:溶液变为蓝色;
方案2:(1)②干燥装置;③装有碱石灰的干燥管;(2)H2+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O.
点评 本题是一道性质实验方案的设计考题,注意知识的迁移和应用是解题的关键,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
9.“归纳与比较”是化学学习的重要方法,下列有关CO2与CO的知识归纳错误的是( )
| A. | A组成 | 1个二氧化碳分子比1个一氧化碳分子多1个氧原子. |
| B. | 性质 | 都是无色无味的气体;都能溶于水,水溶液显酸性;都能与碱反应;都能燃烧等. |
| C. | 用途 | CO2可用于光合作用、灭火、化工产品的原料和气体肥料,“干冰”可用于人工降雨等;CO可用作气体燃料、冶炼金属的还原剂等. |
| D. | 危害 | CO2会造成“温室效应”;CO极易与血液中的血红蛋白结合引起中毒等. |
| A. | A | B. | B | C. | C | D. | D |
7.儿童可以从下列食物中获得人体所需要的钙的是( )
| A. |  牛奶 | B. |  大米 | C. |  蔬菜 | D. |  花生 |
4.下列化学方程式中正确的是( )
| A. | 2Fe+6HCl═2FeCl3 +3H2 ↑ | B. | 2NaOH+K2CO3═2KOH+Na2CO3 | ||
| C. | CO+CuO$\frac{\underline{\;△\;}}{\;}$CO2+Cu | D. | 4P+5O2 $\frac{\underline{\;燃烧\;}}{\;}$2P2O5 |
11.化学学习小组做实验时记录了下列实验现象,其中不正确的是( )
| A. | 细铁丝在氧气中燃烧有黑色固体生成 | |
| B. | 硫磺在空气中燃烧产生蓝紫色火焰 | |
| C. | 打开盛放浓氨水的试剂瓶瓶塞后,出现白雾 | |
| D. | 向紫色石蕊试液中通入二氧化碳,试液变红 |
9.下列实验现象描述不正确的是( )
| A. | 红磷在空气中燃烧,产生大量白烟 | B. | 木炭在氧气中燃烧,发出白光 | ||
| C. | 细铁丝在氧气中燃烧,火星四射 | D. | 硫在氧气中燃烧,火焰呈淡蓝色 |

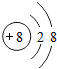 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.