题目内容
2.某实验小组的同学为了测定实验室中高锰酸钾样品的质量分数,取7g该样品,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量/g | 6.88 | 6.55 | 6.36 | 6.36 |
(1)加热t3时间后高锰酸钾是否已经完全反应?是(填“是”或“否”);高锰酸钾中锰、氧元素的质量比为55:64.
(2)求完全反应后产生氧气的质量.
(3)求该样品中高锰酸钾的质量分数.(精确到0.1%)
分析 高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应前后的质量差即为生成氧气的质量,根据氧气质量可以计算高锰酸钾质量,进一步可以计算高锰酸钾的质量分数.
解答 解:(1)加热t3时间后,剩余固体质量不再变化,说明高锰酸钾已经完全反应;
高锰酸钾中锰、氧元素的质量比为:55:(16×4)=55:64.
是; 55:64.
(2)反应生成氧气质量为:7g-6.36g═0.64g,
答:生成了0.64g氧气.
(3)设KMnO4的质量为x,
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
316 32
x 0.64g
$\frac{316}{x}$=$\frac{32}{0.64g}$,
x=6.32g,
KMnO4的质量分数为:$\frac{6.32g}{7g}$×100%=90.3%,
答:样品中KMnO4的质量分数为90.3%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目

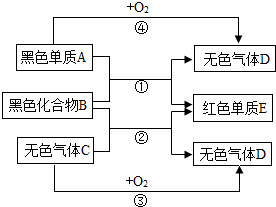 已知A,B,C,D,E是初中化学中常见的五种物质,气体D能使澄清石灰水变浑浊,它们之间有如图所示的转化关系
已知A,B,C,D,E是初中化学中常见的五种物质,气体D能使澄清石灰水变浑浊,它们之间有如图所示的转化关系 如图是探究燃烧条件的实验,图示的现象与实验事实不相符合,火焰出现的地方应该是a(填a、b或c)点,该反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
如图是探究燃烧条件的实验,图示的现象与实验事实不相符合,火焰出现的地方应该是a(填a、b或c)点,该反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.

