题目内容
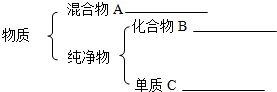
14.酸、碱、盐都是重要的化合物,请回答下列有关问题.(1)碳酸钠溶液显碱性,请简述测定该溶液pH的操作方法用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
(2)下列不属于复分解反应发生条件的是C(填字母).
A.有水生成
B.有气体生成
C.有单质生成
D.有沉淀生成
(3)某化学兴趣小组用一定量的碳酸钠溶液和石灰水反应制取氢氧化钠,并对反应后的溶液成分进行探究.
【提出问题】反应后的溶液中含有哪些溶质?
【做出猜想】甲:NaOH;乙:NaOH、Ca(OH)2;丙:NaOH、Na2CO3、Ca(OH)2;丁:NaOH、Na2CO3.
【交流表达】甲、乙、丙中不合理的猜想及其原因是丙,碳酸钠和氢氧化钙不能共存.
【实验探究】同学们进行了如下实验探究,请将表格内容填写完整.
| 实验步骤 | 现象及化学反应方程式 | 结论 |
| 取少量反应后溶液于试管中,滴加碳酸钠溶液 | 产生白色沉淀,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 猜想乙正确 |
分析 (1)根据溶液pH的测定分析分析;
(2)根据复分解反应发生的条件分析:生成物要求必须含有沉淀,或者是气体,或者是水.;
(3)【做出猜想】根据碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,结合反应的程度分析;
【交流表达】根据碳酸钠和氢氧化钙不能共存分析;
【实验探究】根据氢氧化钙能够和碳酸钠反应产生沉淀进行设计实验验证;
(4)根据质量守恒定律计算二氧化碳的质量并根据化学方程式进行计算.
解答 解:(1)用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH;故答案为:用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH;
(2)复分解反应发生的条件:生成物要求必须含有沉淀,或者是气体,或者是水;故填:C;
(3)【做出猜想】若碳酸钠过量,则含有碳酸钠、氢氧化钠;故填:NaOH、Na2CO3;
【交流表达】碳酸钠和氢氧化钙不能共存,因此不可能同时存在;故填:丙,碳酸钠和氢氧化钙不能共存;
【实验探究】若猜想乙正确,则含有过量的氢氧化钙,因此可以滴加碳酸钠溶液,若产生白色沉淀,则含有氢氧化钙,反应的方程式为:;故填:滴加碳酸钠溶液;产生白色沉淀,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)由质量守恒定律可知,生成的二氧化碳的质量=12g+100g-107.6g=4.4g;
设稀盐酸的溶质质量分数为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
100x 4.4g
$\frac{73}{100x}$=$\frac{44}{4.4g}$ x=7.3%
故稀盐酸中溶质的质量分数为7.3%.
点评 通过回答本题知道了在分析化学反应后所得物质的成分时,除了考虑生成物外,还需考虑反应物是否有剩余,两种物质发生反应时,若其中一种反应物有剩余,可判断另一种反应物一定完全反应.

| A. | 缉毒犬能根据气味发现毒品,是由于分子在不断运动 | |
| B. | 変瘪的乒乓球放入热水中能鼓起来,是由于分子受热变大 | |
| C. | 铝制品中的铝原子是静止不动的 | |
| D. | 将石块研磨成粉状,说明分子变小了 |
| A. | 冰块受热熔化 | B. | 熨斗通电后变热 | ||
| C. | 吃进的食物被消化 | D. | 矿石粉碎 |
| A. | 用霉变的粮食酿酒 | B. | 用有毒农药“神丹农”种植生姜 | ||
| C. | 用食醋除去松花蛋的涩味 | D. | 用未经检验的猪肉制成羊肉出售 |
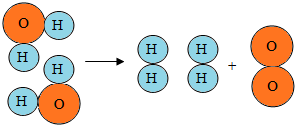 如图,从水分子分解示意图中获得以下信息,其中说法正确的是A
如图,从水分子分解示意图中获得以下信息,其中说法正确的是A 如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题: