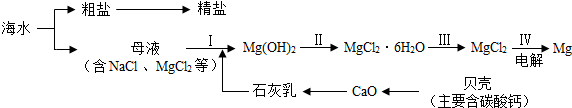
题目内容
3.将氯酸钾和二氧化锰混合物30g,加热制氧气,待反应完全后,称剩余的二氧化锰和氯化钾的混合质量为20.4g.请问:(1)这个反应生成了多少克的氧气?
(2)混合中氯化钾的质量是多少克?
分析 根据质量守恒定律的应用确定氧气的质量,而后利用氧气的质量利用化学方程式进行计算,可求出氯化钾的质量.
解答 解:(1)依据质量守恒定律可知:制得氧气的质量:30g-20.4g=9.6g;
(2)剩下固体含有氯化钾(KCl)和二氧化锰(MnO2),则设剩下固体中KCl的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
149 96
x 9.6g
$\frac{149}{x}$=$\frac{96}{9.6g}$
x=14.9g
答:(1)可制得氧气的质量是9.6g;
(2)剩余固体中含有氯化钾的质量是14.9g.
点评 此题是依据质量守恒定律的应用解答问题,解题的关键是化学方程式的计算,属基础性计算解答题.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
20.除去下列各物质中混有的少量杂质(括号内为杂质),下列方法正确的是( )
| A. | CuO(铜粉)--加入过量的稀硫酸,过滤 | |
| B. | CO2(HCl)--通入足量的NaOH溶液,干燥 | |
| C. | CaCl2溶液(HCl)--加入过量的碳酸钙粉末,过滤 | |
| D. | CuCl2溶液(Na2SO4)--加入适量的Ba(OH)2溶液,过滤 |

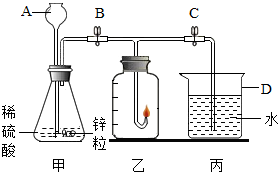 某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:
某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图: