题目内容
11.从海水中制备食盐和金属镁的流程如下所示: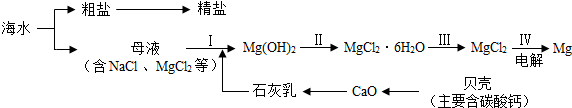
回答下列问题:
(1)步骤 II中需加入一种试剂并进行浓缩,所加试剂是稀盐酸;
(2)粗盐中含有泥沙等杂质,用粗盐制取精盐的实验方法是溶解、过滤、蒸发;
(3)已知电解氯化镁产生两种单质,请写出电解氯化镁的化学方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
分析 (1)步骤 II,氢氧化镁难溶于水,能与稀盐酸反应生成氯化镁和水,据此进行分析解答.
(2)粗盐的主要成分是氯化钠,含有泥沙等杂质,氯化钠易溶于水,泥沙难溶于水,据此进行分析解答.
(3)已知电解氯化镁产生两种单质,由质量守恒定律,反应前后元素种类不变,两种单质分别是镁和氯气,写出反应的化学方程式即可.
解答 解:(1)氢氧化镁难溶于水,能与稀盐酸反应生成氯化镁和水,步骤 II中需加入一种试剂并进行浓缩,所加试剂是稀盐酸.
(2)粗盐的主要成分是氯化钠,含有泥沙等杂质,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程).
(3)已知电解氯化镁产生两种单质,由质量守恒定律,反应前后元素种类不变,两种单质分别是镁和氯气,反应的化学方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
故答案为:(1)稀盐酸;(2)溶解、过滤、蒸发;(3)MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题难度不大,掌握酸的化学性质、粗盐提纯的原理、化学方程式的书写是正确解答本题的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
9.田老师为了让学生更好地理解蛋白质的“盐析”与“变性”,对教材实验进行改进并完成了如下实验.
(1)实验①②③研究的蛋白质的特性是盐析(填“盐析”或“变性”);
(2)补充实验②的目的是说明实验①中蛋白质发生的不是(填“是”或“不是”)化学变化;
(3)设计对比实验①、③的目的是证明实验①中析出的沉淀是蛋白质而不是硫酸铵;
(4)针对实验④,小黄同学提出了质疑:使蛋白质发生上述变化的是否为重金属离子.请补充完成实验⑥,供选择的试剂有:鸡蛋清、蒸馏水、食盐水、硫酸铜溶液、浓硝酸.
| 序号 | 实验操作 | 实验现象 |
| ① | 在盛有鸡蛋清的试管中滴加饱和硫酸铵溶液 | 有白色絮状沉淀 |
| ② | 将①所得沉淀取出少许放入试管中,加入足量蒸馏水 | 沉淀完全溶解 |
| ③ | 在装有硫酸铵晶体的试管中加少量蒸馏水 | 沉淀完全溶解 |
| ④ | 在盛有鸡蛋清溶液的试管中滴加乙酸铅溶液 | 有沉淀 |
| ⑤ | 将④所得沉淀取出少许放入试管中,加入足量蒸馏水 | 沉淀未溶解 |
(2)补充实验②的目的是说明实验①中蛋白质发生的不是(填“是”或“不是”)化学变化;
(3)设计对比实验①、③的目的是证明实验①中析出的沉淀是蛋白质而不是硫酸铵;
(4)针对实验④,小黄同学提出了质疑:使蛋白质发生上述变化的是否为重金属离子.请补充完成实验⑥,供选择的试剂有:鸡蛋清、蒸馏水、食盐水、硫酸铜溶液、浓硝酸.
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ⑥ | 在盛有鸡蛋清溶液的试管中滴加硫酸铜溶液,取上述沉淀少许于试管中,加入足量的蒸馏水 | 有沉淀,沉淀未溶解 | 重金属离子使蛋白质发生了变化 |
6.实验室有一瓶接近饱和的Ca(OH)2溶液,佳佳同学欲将其变成饱和溶液,以下方法中你认为不可行的是( )
| A. | 升高溶液温度 | B. | 降低溶液温度 | ||
| C. | 等温蒸发适量溶剂 | D. | 加入适量Ca(OH)2固体 |
16.将下列物质加入水中,一周后出现黑臭现象的是( )
| A. | 盐酸 | B. | 氢氧化钠 | C. | 食盐 | D. | 牛奶 |
20.实验室制取氢气时,应选用的反应物是( )
| A. | 铁和浓硫酸 | B. | 锌和稀硝酸 | C. | 铜和盐酸 | D. | 锌和稀硫酸 |
