题目内容
8.下列关于实验现象的描述,正确的是( )| A. | 硫在氧气中的燃烧,发出微弱的淡蓝色火焰 | |
| B. | 红磷在空气中燃烧时,产生大量白色烟雾 | |
| C. | 细铁丝在空气中燃烧时,火星四射,生成黑色固体 | |
| D. | 向紫色石蕊溶液中通入二氧化碳气体,溶液由紫色变为红色 |
分析 A、根据硫在氧气中的燃烧的现象进行分析判断.
B、根据木炭燃烧的现象进行分析判断.
C、根据细铁丝在空气中不能燃烧进行分析判断.
D、根据向紫色石蕊溶液中通入二氧化碳气体进行分析判断.
解答 解:A、硫在氧气中的燃烧,发出蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法错误.
B、红磷在空气中燃烧,产生大量的白烟,没有雾,故选项说法错误.
C、细铁丝在空气中不能燃烧,故选项说法错误.
D、向紫色石蕊溶液中通入二氧化碳气体,溶液由紫色变为红色,故选项说法正确.
故选D.
点评 本题难度不大,掌握常见物质燃烧的现象即可正确解答;在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.

练习册系列答案
相关题目
18.某校学习小组准备探究气体的测定和数据处理方法.
【提出问题】
如何利用石灰石(主要成分为CaCO3))与稀盐酸发应来测定生成CO2的质量和体积,并处理数据.
【实验设计】通过下列两个实验分别测定CO2的质量和体积:

【分析与表达】
(1)上述两个实验中,反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是最后一次加入稀盐酸,仍没有气泡产生.
(3)实验Ⅱ中,先连接好装置,再检查装置的气密性(填操作名称),然后装好药品,最后将10mL稀盐酸快速推入烧瓶中.观察到的现象为:烧瓶内石灰石表面冒气泡,注射器活塞向右移动;烧瓶内气压增大,稀盐酸难以完全推入烧瓶中或仪器连接处脱落.
【记录与处理】
(4)已知实验I反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是AC.
A.m(小烧杯) B.m(大烧杯) C.m(大烧杯+反应后剩余物)
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定):
【提出问题】
如何利用石灰石(主要成分为CaCO3))与稀盐酸发应来测定生成CO2的质量和体积,并处理数据.
【实验设计】通过下列两个实验分别测定CO2的质量和体积:

【分析与表达】
(1)上述两个实验中,反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是最后一次加入稀盐酸,仍没有气泡产生.
(3)实验Ⅱ中,先连接好装置,再检查装置的气密性(填操作名称),然后装好药品,最后将10mL稀盐酸快速推入烧瓶中.观察到的现象为:烧瓶内石灰石表面冒气泡,注射器活塞向右移动;烧瓶内气压增大,稀盐酸难以完全推入烧瓶中或仪器连接处脱落.
【记录与处理】
(4)已知实验I反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是AC.
A.m(小烧杯) B.m(大烧杯) C.m(大烧杯+反应后剩余物)
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定):
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 注射器读数/mL | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
19.有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3溶液中的一种.为区别这四种溶液,现将它们两两混合并得到下面现象( )
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | HCl、BaCl2、H2SO4Na2CO3 | B. | H2SO4、HCl、BaCl2、Na2CO3 | ||
| C. | HCl、H2SO4、BaCl2、Na2CO3 | D. | H2SO4、Na2CO3、HCl、BaCl2 |
16.同学们在实验室进行“粗盐中难溶性杂质的去除”实验.以下是小红同学的实验报告的部分内容.
【实验目的】体验固体混合物初步提纯的实验过程.学习蒸发操作技能,巩固溶解、过滤操作技能.
【实验步骤】
①用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛有10mL水的烧杯里,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐,计算10mL水中溶解了多少克粗盐.
②过滤食盐水,观察滤液是否澄清.如滤液仍浑浊,则再过滤一次.
③将所得澄清滤液倒入蒸发皿,加热,并用玻璃棒不断搅拌,当液体蒸干时,停止加热;
④用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率.
【实验分析】
(1)步骤③中出现的错误操作是到液体蒸干时才停上加热.
(2)在蒸发过程中,玻璃棒的作用是B(填字母序号).
A.加快蒸发速率 B.防止因局部温度过高,造成液滴飞溅 C.引流
【实验反思】经过这样操作所得到的精盐是纯净物吗?
【查阅资料】粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).
【实验设计】
【实验结论】除去难溶性杂质得到的精盐不是纯净物.
【实验目的】体验固体混合物初步提纯的实验过程.学习蒸发操作技能,巩固溶解、过滤操作技能.
【实验步骤】
①用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛有10mL水的烧杯里,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐,计算10mL水中溶解了多少克粗盐.
②过滤食盐水,观察滤液是否澄清.如滤液仍浑浊,则再过滤一次.
③将所得澄清滤液倒入蒸发皿,加热,并用玻璃棒不断搅拌,当液体蒸干时,停止加热;
④用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率.
【实验分析】
(1)步骤③中出现的错误操作是到液体蒸干时才停上加热.
(2)在蒸发过程中,玻璃棒的作用是B(填字母序号).
A.加快蒸发速率 B.防止因局部温度过高,造成液滴飞溅 C.引流
【实验反思】经过这样操作所得到的精盐是纯净物吗?
【查阅资料】粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).
【实验设计】
| 实验操作 | 预计实验现象 | 实验结论及解释 |
| ①将少量所得精盐溶于水,滴加少量稀NaOH溶液 | 出现白色沉淀 | 所得精盐中可能含有氯化镁. 化学方程式MgCl2+2NaOH═Mg(OH)2↓+2NaCl |
| ②取实验①中的上层清液继续滴加NaOH溶液至不再有沉淀时,在上层清液中再滴加碳酸钠溶液 | 出现白色沉淀 | 所得精盐中可能含有氯化钙 |
13.某同学在学习溶液时进行了如下实验探究:

(1)上述实验所形成的溶液中,溶质是硝酸钾.
(2)上述①②③烧杯的溶液,一定属于饱和溶液的是②[填烧杯编号].
(3)若要使烧杯②中的剩余固体全部溶解,除了实验中已经采取的措施外,还可以采取的措施为:升高温度.
(4)图2是氯化钠和硝酸钾两种固体物质的溶解度曲线,图中b表示氯化钠的溶解度曲线;在t1℃时,硝酸钾饱和溶液中溶质的质量分数小于(填大于、小于或等于)氯化钠饱和溶液中溶质的质量分数.
氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表:

(1)上述实验所形成的溶液中,溶质是硝酸钾.
(2)上述①②③烧杯的溶液,一定属于饱和溶液的是②[填烧杯编号].
(3)若要使烧杯②中的剩余固体全部溶解,除了实验中已经采取的措施外,还可以采取的措施为:升高温度.
(4)图2是氯化钠和硝酸钾两种固体物质的溶解度曲线,图中b表示氯化钠的溶解度曲线;在t1℃时,硝酸钾饱和溶液中溶质的质量分数小于(填大于、小于或等于)氯化钠饱和溶液中溶质的质量分数.
氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表:
| 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
| NaCl(g) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3(g) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
20.下列有关生命、材料、环境、能源的说法正确的是( )
| A. | 维生素是六大营养素之一 | |
| B. | 铝合金、塑料都是合成材料 | |
| C. | 一氧化碳、二氧化碳都是大气污染物 | |
| D. | 风能、氢气都是不可再生的化石燃料 |
17.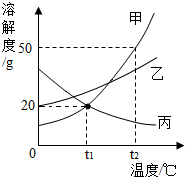 如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.下列说法正确的是( )
如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.下列说法正确的是( )
 如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.下列说法正确的是( )
如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.下列说法正确的是( )| A. | 将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质质量分数都不变 | |
| B. | t2℃时,物质甲的饱和溶液的溶质质量分数为50% | |
| C. | t1℃时,甲、丙的饱和溶液中溶质与溶液的质量比均为1:5 | |
| D. | 升高丙溶液的温度,一定有晶体析出 |
 我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们习惯“夏天晒盐 (NaCl)、冬天捞碱(Na2CO3)”.Na2CO3和NaCl两物质的溶解度曲线如下图所示,据图回答下列问题:
我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们习惯“夏天晒盐 (NaCl)、冬天捞碱(Na2CO3)”.Na2CO3和NaCl两物质的溶解度曲线如下图所示,据图回答下列问题: