题目内容
4. 丙醇在很多情况下可代替沸点较低的乙醇用作有机溶剂,如图是丙醇的分子结构图,其化学式为C3H7OH.下列有关丙醇的说法正确的是( )
丙醇在很多情况下可代替沸点较低的乙醇用作有机溶剂,如图是丙醇的分子结构图,其化学式为C3H7OH.下列有关丙醇的说法正确的是( )| A. | 丙醇是由碳、氢、氧三种原子构成的 | |
| B. | 丙醇中碳、氢、氧的质量比为3:8:1 | |
| C. | 丙醇中氢元素的质量分数最大 | |
| D. | 丙醇不属于氧化物,但属于有机化合物 |
分析 A.根据物质的结构来分析;
B.根据化合物中元素的质量比来分析;
C.根据化合物中元素的质量分数计算方法来分析;
D.根据氧化物与有机物的概念来分析.
解答 解:A.丙醇是由丙醇分子构成的,而不是由原子直接构成的,故错误;
B.丙醇(C3H7OH)中碳、氢、氧的质量比为:(12×3):(1×8):16=36:8:16≠3:8:1,故错误;
C.丙醇(C3H7OH)中碳、氢、氧的质量比为:(12×3):(1×8):16=36:8:16=9:2:4,可见其中碳元素的质量分数最大,故错误;
D.氧化物是由两种元素组成的化合物,丙醇(C3H7OH)中含三种元素,不属于氧化物,该物质是含碳元素的化合物,属于有机化合物,故正确.
故选D.
点评 本题考查了化学式的意义以及化学式的计算方法,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
14.我们可以利用如图所示的三种关系对某些知识进行归纳梳理.下列判断正确的是( )

| A. | 碱性溶液和碱溶液:包含关系 | B. | 复分解反应和中和反应:并列关系 | ||
| C. | 氧化物和化合物:交叉关系 | D. | 化学肥料和复合肥料:并列关系 |
15.除去下列物质中含有的杂质,所选用的试剂和操作都正确的一组是( )
| 物质 | 所含杂质 | 除去杂质的试剂与操作 | |
| A | FeCl2溶液 | CuCl2 | 过量锌粉,过滤 |
| B | Cu | CuO | O2,加热 |
| C | KCl | KClO3 | MnO2,加热 |
| D | CaCl2溶液 | 稀盐酸 | 过量CaCO3,过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.化学实验现象绚丽多彩.如图是无色溶液X发生化学反应时的颜色变化,无色溶液X是( )

| A. | 稀盐酸 | B. | 稀硫酸 | C. | 澄清石灰水 | D. | 硫酸钠溶液 |
9.为了测定碳酸钠样品中碳酸钠的质量分数是多少,取12g碳酸钠样品溶于水中,将氯化钙溶液均分为三份,依次加入到盛有碳酸钠溶液的烧杯中,每次加入氯化钙溶液后生成沉淀的质量总和如下表所示:
(1)表格中m的数值是8.
(2)求碳酸钠样品中碳酸钠的质量分数?(百分数保留一位小数)
| 加入氯化钙溶液次数 | 第一次 | 第二次 | 第三次 |
| 生成沉淀的总质量/g | 4 | m | 10 |
(2)求碳酸钠样品中碳酸钠的质量分数?(百分数保留一位小数)
16.经过一年的化学学习,小宇同学对以下所学知识进行整理,正确的是( )
| A | 不同物质性质不同,鉴别方法不同 | 氧化铜与碳粉一一在空气中灼烧 |
| B | 物质在微观上都是由粒子构成的 | 铁一一由分子构成 |
| C | 物质的性质决定了它的反应现象 | 向NaOH溶液中滴加紫色石蕊试液一一溶液变为红色 |
| D | 混合物除去杂质(括号内为杂质) | FeSO4溶液(稀H2SO4)一一加入过量的氧化铁,过滤 |
| A. | A | B. | B | C. | C | D. | D |
13.“低碳减排•绿色生活”是环境保护重要理念,下列做法不符合这一理念的是( )
| A. | 植树造林,绿化家园 | B. | 推广使用太阳能、风能 | ||
| C. | 骑公共自行车出行 | D. | 露天焚烧秸秆和垃圾 |
13.医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
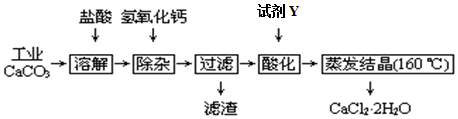
已知:查阅资料得知氢氧化物沉淀时的pH为:
(1)CaCO3与盐酸反应的离子方程式CaCO3+2H+=Ca 2++H2O+CO2↑
(2)除杂操作是加入氢氧化钙,调节溶液的pH范围应为2.3≤pH≤7.8(提示:找出PH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如“边界值1<PH<边界值2”等等的不等式来表示PH范围),其目的是让铁离子和氯离子完全沉淀.
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和漏斗
(4)酸化的目的是:除去过量的氢氧化钙.所加试剂Y 名称为盐酸
(5)蒸发结晶要保持在160℃,为什么温度不能太高:由于要制备的是水合物,温度太高会导致水合物分解脱水.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一是过程中除去了铁离子和氯离子,而钠离子没有去除,导致得到的水合物含有钠的化合物.

已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(2)除杂操作是加入氢氧化钙,调节溶液的pH范围应为2.3≤pH≤7.8(提示:找出PH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如“边界值1<PH<边界值2”等等的不等式来表示PH范围),其目的是让铁离子和氯离子完全沉淀.
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和漏斗
(4)酸化的目的是:除去过量的氢氧化钙.所加试剂Y 名称为盐酸
(5)蒸发结晶要保持在160℃,为什么温度不能太高:由于要制备的是水合物,温度太高会导致水合物分解脱水.
(6)若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一是过程中除去了铁离子和氯离子,而钠离子没有去除,导致得到的水合物含有钠的化合物.
