题目内容
10.根据如图回答下列问题.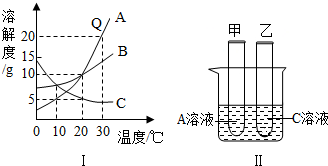
(1)20℃时分别向100g水中加入8gA、B、C物质,充分搅拌溶解后,形成饱和溶液的物质是C;
(2)如图Ⅱ所示,甲、乙两支试管中分别装有20℃时制成的A、C的饱和溶液,将它们同时放入装有0℃冰水的烧杯中,一段时间后可观察到的现象是甲试管中有晶体析出,乙试管中无明显现象;
(3)要使B从其溶液中全部析出,可采用的方法是蒸干溶剂.
分析 溶解度曲线能定量表示溶解度随温度的变化情况,根据固体物质的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小;②判断物质的溶解度随温度变化的变化情况.据此解答.
解答 解:(1)据图可以看出,20℃时ABC的溶解度分别是10g、10g,5g,加入8gA、B、C物质,充分搅拌溶解后,c不能全部溶解,形成的是饱和溶液,故填:C;
(2)甲、乙两支试管中分别装有20℃时制成的A、C的饱和溶液,将它们同时放入装有0℃冰水的烧杯中,甲的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,故一段时间后可观察到甲试管中有晶体析出,乙试管中无明显现象,故填:甲试管中有晶体析出,乙试管中无明显现象;
(3)要使B从其溶液中全部析出,可采用蒸干溶剂的方法,故填:蒸干溶剂.
点评 本题难度不大,主要考查了根据固体物质的溶解度曲线解决相关的问题,培养学生的分析能力和解题能力.

练习册系列答案
相关题目
5.下列有关实验操作的说法中,错误的是( )
| A. | 做氢气燃烧的实验前要先检验纯度再点燃 | |
| B. | 做一氧化碳还原氧化铜实验时要先通一段时间一氧化碳再加热 | |
| C. | 用PH试纸测溶液的酸碱度时,要先将试纸润湿再滴待测液 | |
| D. | 稀释浓硫酸时要先在烧杯中加水,再加浓硫酸并用玻璃棒不断搅拌 |
2.下列有关生活中化学知识的说法,正确的是( )
| A. | 纯棉床单、塑料包装袋、电木插座等都属于有机合成材料 | |
| B. | 糖类和油脂在人体内转化后能为机体供能 | |
| C. | 钙、铁、铅都是人体必需的微量元素 | |
| D. | 生活中常用甲醛浸泡水产品,达到保鲜的目的 |
19.下列的陈述中Ⅰ、Ⅱ的因果关系正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 生石灰易与水反应 | 生石灰常用作食品干燥剂 |
| B | 氢气是最轻的气体 | 点燃氢气前要验纯 |
| C | 二氧化碳用于灭火 | 二氧化碳没有毒性 |
| D | 取液时试剂瓶塞倒放在桌面上 | 液体药品盛放在细口瓶 |
| A. | A | B. | B | C. | C | D. | D |
 如图,A~G是初中化学中常见的物质,其中C、D、E都是无色气体,B是一种常见的液体,F是一种红色粉末、图中→表示物质间存在转化关系(部分生成物和部分反应条件已略去).
如图,A~G是初中化学中常见的物质,其中C、D、E都是无色气体,B是一种常见的液体,F是一种红色粉末、图中→表示物质间存在转化关系(部分生成物和部分反应条件已略去).
 在实验室中进行粗盐的提纯,其主要操作步骤为:
在实验室中进行粗盐的提纯,其主要操作步骤为: 食盐在生产和生活中具有广泛的用途.
食盐在生产和生活中具有广泛的用途.