题目内容
1.已知A的无色溶液与黑色固体B常温混合反应,生成无色气体C;另一种黑色固体D能在C中燃烧,生成能使澄清石灰水变浑浊的气体无色气体E;如把黄色粉末F点燃后放入盛C的集气瓶中,能剧烈燃烧,生成一种无色有刺激性气味的气体G请回答:(1)写出下列物质的名称或化学式:A过氧化氢溶液,B二氧化锰,F硫.
(2)写出D在C中燃烧的文字表达式碳+氧气$\stackrel{点燃}{→}$二氧化碳;基本反应类型是化合反应.
(3)写出F在C中燃烧的文字表达式硫+氧气$\stackrel{点燃}{→}$二氧化硫.
分析 根据题意:根据“无色溶液A与黑色固体B常温混合反应,生成无色气体C,另一种黑色固体D能在C中燃烧,生成能使澄清石灰水变浑浊的气体无色气体E”,则E为二氧化碳,碳在氧气中燃烧生成二氧化碳,则D为碳,C为氧气;过氧化氢在二氧化锰的催化作用下生成水和氧气,则A为过氧化氢溶液,B为二氧化锰;根据“把黄色粉末F点燃后放入盛C的集气瓶中,能剧烈燃烧,生成一种无色有刺激性气味的气体G”,则说明F为硫,G为二氧化硫,据此进行分析解答.
解答 解:根据“无色溶液A与黑色固体B常温混合反应,生成无色气体C,另一种黑色固体D能在C中燃烧,生成能使澄清石灰水变浑浊的气体无色气体E”,则E为二氧化碳,碳在氧气中燃烧生成二氧化碳,则D为碳,C为氧气;过氧化氢在二氧化锰的催化作用下生成水和氧气,则A为过氧化氢溶液,B为二氧化锰;根据“把黄色粉末F点燃后放入盛C的集气瓶中,能剧烈燃烧,生成一种无色有刺激性气味的气体G”,则说明F为硫,G为二氧化硫.代入检验,符合题意.
(1)根据分析,A的名称为过氧化氢溶液,B为二氧化锰,C为氧气,D为碳,E为二氧化碳,F为硫,G为二氧化硫.
(2)D在C中燃烧,即碳在氧气中燃烧生成二氧化碳,反应的文字表达式为碳+氧气$\stackrel{点燃}{→}$二氧化碳,为化合反应.
(3)F在C中燃烧,即硫在氧气中燃烧生成二氧化硫,反应的文字表达式为硫+氧气$\stackrel{点燃}{→}$二氧化硫.
故答案为:
(1)过氧化氢溶液;(2)碳+氧气$\stackrel{点燃}{→}$二氧化碳.(3)硫+氧气$\stackrel{点燃}{→}$二氧化硫.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

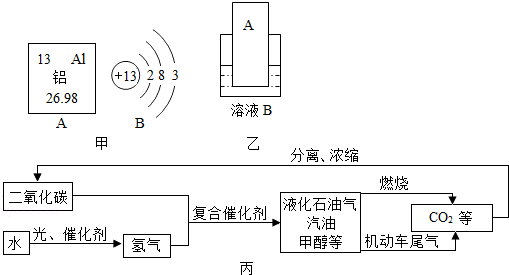
(1)元素周期表中铝元素的信息如图甲所示,其相对原子质量为26.98.化学反应中该原子容易失去(填“得到”或“失去”)电子;
(2)Al-30书写形式和数字含义与C-12相似(12表示相对原子质量),则Al-30的中子数为17.
(3)铝制品在生活中因耐用而应用越来越广泛,主要原因是常温下,铝制品表面会有一层致密的氧化膜,阻止铝进一步被氧化.
(4)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于混合物(填“混合物”或“纯净物”).
(5)要通过图乙实验得出铝和铜的金属活动性顺序,如果B是硫酸铜溶液,则金属A是Al(填化学式),如果A是铜,则溶液B中溶质的名称是硫酸铝.
(6)中国高铁迅速发展,截止2014年12月26日,中国高铁运营总里程超过15000公里,约占世界高铁运营里程的50%,稳居世界榜首.在焊接钢轨等大截面钢材部件时会利用铝热反应,其化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒,有熔融物生成”.查阅资料知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2990 | 2750 | -- |
(7)月球富含钛铁矿,主要成分是钛酸亚铁(FeTiO3),其中钛(Ti)的化合价是+4 .
材料一:2014年5月27日,中国中航工业航材院相关人士向《环球时报》透露,他们成功利用石墨烯与铝合金在全球率先研制出“烯合金”,宣布具有特殊性能的系列材料问世.这一成果,或许将对航空航天器带来革命性变革.
材料二:石墨烯是从石墨中分离出来的单层石墨片,在室温下可以单独稳定存在,具有优异的导电、导热性能.
(8)写出石墨烯在空气中完全燃烧的化学反应方程式C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
(9)将适量的烯合金放入足量稀硫酸中,在烯合金的表面产生大量气泡,请写出该反应的化学方程式2Al+3H2SO4=Al2(SO4)3+3H2↑.
(10)如图丙是科学家正在研究的二氧化碳循环利用技术,①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式CO2+3H2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CH4O+H2O .
②尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质X发生反应:CO2+2X═CO(NH2)2+H2O,物质X的化学式为NH3.
| A. | 用高锰酸钾制氧气,加热时试管的管口应略向下倾斜 | |
| B. | 制备气体前,先装药,然后检查装置的气密性 | |
| C. | 实验结束后,可以用嘴吹灭酒精灯 | |
| D. | 将用剩的药品放回原试剂瓶 |
①下列方法能检查该装置气密性的是AB.
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
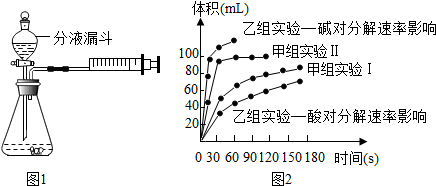
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
②二氧化锰催化下过氧化氢分解的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
③甲小组有如下实验设计方案,完成下表.
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对过氧化氢分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%过氧化氢 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%过氧化氢 |
Ⅰ甲组实验得出的数据可知:浓度越大,过氧化氢分解速率越快;
Ⅱ由乙组研究的酸、碱对过氧化氢分解影响因素的数据分析:相同条件下,过氧化氢在碱(填“酸”或“碱”)性环境下放出气体速率较快.
 如图所示,为了让水中的白磷燃烧起来,小明通过导气管用嘴向水中吹气,结果白磷未能燃烧.请回答:
如图所示,为了让水中的白磷燃烧起来,小明通过导气管用嘴向水中吹气,结果白磷未能燃烧.请回答: 构建知识网络是学习化学的重要方法之一,某同学在学习酸和碱的化学性质后,归纳的知识网络如图,图中“-”两端的物质可以反应,请帮助该同学进行完善和研究.
构建知识网络是学习化学的重要方法之一,某同学在学习酸和碱的化学性质后,归纳的知识网络如图,图中“-”两端的物质可以反应,请帮助该同学进行完善和研究.