题目内容
12.2015年6月1日21时30分,“东方之星”客轮在从南京驶往重庆途中突遇龙卷风,在长江中游湖北监利水域翻沉,造成特大事故.搜救人员携带氧气瓶潜入水下船舱搜寻,另外搜救人员在朝下的船底处切割探孔进行探测.(1)搜救人员潜入水中必须携带氧气瓶,这是因为氧气能供给呼吸.
(2)切割用钢铁做成的船底需要高温氧炔焰,它是乙炔在充足的氧气中产生的,通过调节乙炔和氧气进气阀门,可以改变两种气体比例,从而控制氧炔焰的温度.乙炔在足量的氧气中完全燃烧的化学方程式为2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2,此时乙炔和氧气的微粒个数比为2:5,为提高氧炔焰的温度,切割人员控制进气阀门的操作是适量调大进入氧气的阀门,从微观角度解释该操作的原因是增大了乙炔分子与氧分子发生接触的几率.
(3)关闭乙炔阀门,火焰就会熄灭,该灭火方法的目的是移走可燃物.
分析 (1)根据氧气的性质与用途来分析;
(2)根据化学方程式的写法与意义、促进燃料燃烧的方法来分析;
(3)根据灭火的原理来分析.
解答 解:(1)氧气能够供给呼吸,所以搜救人员潜入水中必须携带氧气瓶,故填:供给呼吸;
(2)乙炔燃烧的反应物是乙炔和氧气,生成物是二氧化碳和水,方程式为:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2,由化学方程式可知,乙炔和氧气的微粒个数比为2:5,为提高氧炔焰的温度,切割人员控制进气阀门的操作是适量调大进入氧气的阀门,促进乙炔的燃烧;增大了乙炔分子与氧分子发生接触的几率;故填:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2;2:5;适量调大进入氧气的阀门;增大了乙炔分子与氧分子发生接触的几率;
(3)关闭燃气阀门,相当于移走可燃物,火焰熄灭.故填:移走可燃物.
点评 本题考查了氧气的性质与用途、化学方程式的写法和意义以及灭火的方法等,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.欲除去下列物质中的少量杂质,所用试剂正确的是( )
| 选项 | 物质 | 杂质 | 试剂 |
| A | CO2 | SO2 | NaOH溶液 |
| B | KCl | K2SO4 | Ba(OH)2溶液 |
| C | CO2 | CO | Ca(OH)2溶液 |
| D | CaCO3 | CuSO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
17.某学习小组在探究CO2与NaOH溶液反应的实验中,先用铝制易拉罐收集满一罐CO2气体,然后迅速向其中加入一定量的NaOH浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计).
【提出问题】易拉罐为什么先瘪后鼓?
【分析猜想】易拉罐开始时变瘪的原因是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示),易拉罐重新鼓起的原因是易拉罐中又生成了气体A,其成分极有可能是CO2或 H2.
【查阅资料】①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝单质比较容易被酸、碱腐蚀.
【设计方案并进行实验】为了检验铝制易拉罐中重新生成的气体成分,小组又进行如下实验,并记录了相应的实验现象:
【实验结论】①铝制易拉罐变瘪的原因是CO2被NaOH溶液吸收,②铝制易拉罐重新鼓起的原因是铝与NaOH溶液反应产生了气体.
【反思评价】小组根据实验探究获得一条对金属铝化学性质的新认识:铝单质既能与酸反应,又能与碱反应,均能生成氢气.
【拓展延伸】Al与NaOH溶液反应产生了气体的同时还生成另一种书写形式类似于KMnO4的盐,请完成下列反应化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.当然,本实验只是初步探究,还有进一步探究的价值,有待我们在以后的学习中去深究.
【提出问题】易拉罐为什么先瘪后鼓?
【分析猜想】易拉罐开始时变瘪的原因是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示),易拉罐重新鼓起的原因是易拉罐中又生成了气体A,其成分极有可能是CO2或 H2.
【查阅资料】①Na2CO3具有较强的热稳定性,只有在高温条件下才会分解;
②铝单质比较容易被酸、碱腐蚀.
【设计方案并进行实验】为了检验铝制易拉罐中重新生成的气体成分,小组又进行如下实验,并记录了相应的实验现象:
| 实验步骤 | 实验现象 | 实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口. | 发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭. | 说明罐中重新生成的气体A是氢气(H2). |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液. | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体. | 说明铝是否与水直接反应:否(填“是”或“否”),铝能够与NaOH(碱性)溶液反应. |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸. | 产生了无色无味气体,该气体能使澄清石灰水变浑浊. | 说明原CO2气体被NaOH溶液吸收. |
【反思评价】小组根据实验探究获得一条对金属铝化学性质的新认识:铝单质既能与酸反应,又能与碱反应,均能生成氢气.
【拓展延伸】Al与NaOH溶液反应产生了气体的同时还生成另一种书写形式类似于KMnO4的盐,请完成下列反应化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.当然,本实验只是初步探究,还有进一步探究的价值,有待我们在以后的学习中去深究.
4.实验室常用加热氯酸钾与二氧化锰固体混合物的方法来制取氧气.请写出该反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(1)某同学发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂.
【完成实验】按下表进行实验,并测定分解温度(分解温度越低,催化效果越好).
【分析数据、得出结论】
(2)由实验①与实验④对比,可证明猜想合理;使用催化剂所产生氧气的总质量不变(填“减小”、“增大”或“不变”).
(3)实验所用的三种金属氧化物,催化效果最好的是二氧化锰.
【反思拓展】
(4)若要证明氧化铁是利用氯酸钾制取氧气的该反应的催化剂,还要验证氧化铁在化学反应前后的质量和化学性质不变;
(5)若使用同种催化剂,还有哪些因素可能影响催化效果,只要说明一种即可反应物和催化剂的质量比.
(1)某同学发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂.
【完成实验】按下表进行实验,并测定分解温度(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO(质量比1:1) | 370 |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
(2)由实验①与实验④对比,可证明猜想合理;使用催化剂所产生氧气的总质量不变(填“减小”、“增大”或“不变”).
(3)实验所用的三种金属氧化物,催化效果最好的是二氧化锰.
【反思拓展】
(4)若要证明氧化铁是利用氯酸钾制取氧气的该反应的催化剂,还要验证氧化铁在化学反应前后的质量和化学性质不变;
(5)若使用同种催化剂,还有哪些因素可能影响催化效果,只要说明一种即可反应物和催化剂的质量比.
2.实验室用高锰酸钾制取氧气,主要实验步骤有:①加热,②向试管中装药品,③检查装置气密性,④用排水法收集氧气,⑤停止加热,⑥将导管从水槽中取出.正确的实验操作顺序是( )
| A. | ③②①④⑥⑤ | B. | ③②④①⑥⑤ | C. | ②③①④⑤⑥ | D. | ③②①④⑤⑥ |
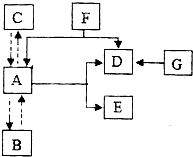 如图所示.A、B、C是水循环的三种自然状态.A为密度最大时的状态.D具有助燃性和氧化性.能与许多物质发生剧烈地、或缓慢地氧化反应.G是白色固体,加热时分解生成D和另一种固体.图中“→”表示物质间A存在转化关系;反应条件、部分反应物和生成物已略去.试回答下列问题.
如图所示.A、B、C是水循环的三种自然状态.A为密度最大时的状态.D具有助燃性和氧化性.能与许多物质发生剧烈地、或缓慢地氧化反应.G是白色固体,加热时分解生成D和另一种固体.图中“→”表示物质间A存在转化关系;反应条件、部分反应物和生成物已略去.试回答下列问题.