题目内容
4.通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.

[交流与表达]
(1)实验操作X中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)实验步骤③的主要目的是MgCl2+2NaOH═Mg(OH)2↓+2NaCl (用化学方程式回答);判断氢氧化钠溶液已过量的方法是取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(3)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小;在蒸发食盐溶液的过程中要使用玻璃棒,作用是搅拌溶液,避免因局部过热,造成液滴飞溅.
(4)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法不可行(选填“可行”或“不可行”),理由是MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
分析 (1)根据实验操作X可以将不溶性物质和溶液分离,依据过滤需要的仪器进行分析;
(2)根据氢氧化钠和氯化镁会生成氢氧化镁沉淀和氯化钠,碱能使酚酞变红色进行分析;
(3)根据氯化钠的溶解度受温度影响较小,蒸发食盐溶液的过程中玻璃棒的作用进行分析;
(4)根据MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去进行分析.
解答 解:(1)实验操作X可以将不溶性物质和溶液分离,所以操作X的是过滤,过滤操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(2)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
判断氢氧化钠溶液已过量的方法是:取样品少许,加入试管中,滴加酚酞试液,溶液变红色;
(3)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小;
在蒸发食盐溶液的过程中要使用玻璃棒,作用是搅拌溶液,避免因局部过热,造成液滴飞溅;
(4)这种方法不可行,因为MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
故答案为:(1)漏斗;
(2)MgCl2+2NaOH═Mg(OH)2↓+2NaCl,取样品少许,加入试管中,滴加酚酞试液,溶液变红色;
(3)氯化钠的溶解度受温度影响较小;搅拌溶液,避免因局部过热,造成液滴飞溅;
(4)不可行,MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
点评 本题涉及除杂、化学方程式的书写、反应进行情况的检验、复分解反应等方面的知识,比较难,是综合性题目.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
5.过氧乙酸的化学式为C2H4O3,常用作消毒剂.请写出下列计算结果.
(1)过氧乙酸中碳、氢、氧三种元素的质量比为6:1:12.
(2)过氧乙酸中氧元素的质量分数为63.2%.(计算结果保留至0.1%)
(1)过氧乙酸中碳、氢、氧三种元素的质量比为6:1:12.
(2)过氧乙酸中氧元素的质量分数为63.2%.(计算结果保留至0.1%)
12.在一定条件下,X、Y、Z、Q四种物质在一密闭容器中充分反应,测得数据如表:
则(1)该容器中发生化学反应的基本类型为分解反应.
(2)反应后测得容器中X的质量为55g.
(3)反应过程中Y、Q的质量比为22:9.
| 物质 | X | Y | Z | Q |
| 反应前物质质量/g | 2 | 2 | 84 | 5 |
| 反应后物质质量/g | 待测 | 24 | 0 | 14 |
(2)反应后测得容器中X的质量为55g.
(3)反应过程中Y、Q的质量比为22:9.
9.下列离子能在pH=l的无色溶液中大量共存的是( )
| A. | Cu2+、SO42-、Cl-、Na+ | B. | OH-、K+、NO3-、Ba2+ | ||
| C. | Na+、CO32-、Ca2+、Cl- | D. | Mg2+、SO42-、Al3+、NO3- |
16.下列物质中,含有原子团,且原子团的化合价为-1价的是( )
| A. | Na2SO4 | B. | Ca(OH)2 | C. | CaCO3 | D. | KCl |
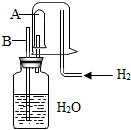 已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小.图中容器A是一种特制的有底的素烧瓷筒,它的壁可以通过氢气分子.实验开始时,A中和烧杯中都充满空气.当向烧杯持续通入氢气时,导管B处发生的现象是有水喷出.
已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小.图中容器A是一种特制的有底的素烧瓷筒,它的壁可以通过氢气分子.实验开始时,A中和烧杯中都充满空气.当向烧杯持续通入氢气时,导管B处发生的现象是有水喷出.
