题目内容
2.现有生活中常见的四种未知白色粉末,它们分别是食盐、纯碱、去污粉(主要成分为碳酸钠和碳酸钙)和使用过的生石灰干燥剂.化学小组为了确定每种未知固体的成分,将它们分别标记为①、②、③、④后进行实验,实验现象记录如下:| 实验过程 | 实验现象 |
| 实验1:分别取样于四支试管中,加入足量的水充分溶解 | ②、③完全溶解,①、④均在试管底部有白色固体,且①中有明显放热 |
| 实验2:静置一段时间后,分别取上层清液,加入试剂A | ③、④均有气泡产生 |
| 实验3:分别取样于四支试管中,加入足量试剂A | 白色固体均消失;①③④均有气泡产生 |
(1)实验1中,物质①发生反应的化学方程式是CaO+H2O═Ca(OH)2.
(2)物质②为食盐,试剂A为稀盐酸(合理即可).
(3)实验3中,试剂A与物质④发生反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑.
分析 根据食盐、纯碱均易溶于水,去污粉的组成成分中碳酸钙难溶于水,生石灰能与水反应生成氢氧化钙,该反应放出大量的热,氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,使用过的生石灰中含有微溶于水的氢氧化钙和难溶于水的碳酸钙,结合题意酸碱盐的化学性质进行分析解答即可.
解答 解:食盐、纯碱均易溶于水,去污粉的组成成分中碳酸钠易溶于水,碳酸钙难溶于水,使用过的生石灰干燥剂中可能含有氧化钙、氢氧化钙和碳酸钙.
实验1:分别取样于四支试管中,加入足量的水充分溶解,②、③完全溶解,①、④均在试管底部有白色固体,且①中有明显放热,则②、③为食盐、纯碱;①为使用过的生石灰干燥剂,④为去污粉.
(1)实验1中,物质①发生反应是生石灰能与水反应生成氢氧化钙,反应的化学方程式是CaO+H2O═Ca(OH)2.
(2)碳酸盐能与稀盐酸反应生成二氧化碳气体,实验2:静置一段时间后,分别取上层清液,加入试剂A,③、④均有气泡产生,则③为纯碱,物质②为食盐.试剂A为稀盐酸(合理即可).
(3)碳酸盐能与稀盐酸反应生成二氧化碳气体,实验3:分别取样于四支试管中,加入足量试剂A,白色固体均消失;①③④均有气泡产生,则①③④中均含有碳酸盐,氯化钠易溶于盐酸中的溶剂水,所以固体也消失.④为去污粉(主要成分为碳酸钠和碳酸钙),碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式分别是Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑.
故答案为:(1)CaO+H2O═Ca(OH)2;(2)食盐;稀盐酸(合理即可);(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题有一定难度,在解决鉴别物质题时,判断的依据是:所选试剂需要与待鉴别的物质反应并出现明显不同的现象;熟练掌握常见酸碱盐的性质是正确解答本题的关键.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 有咸味可做调味品 | B. | 钠元素的化合价是+1价 | ||
| C. | 由氯化钠离子构成 | D. | 钠比氯元素质量分数小 |
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴加硫酸铜溶液 | 出现蓝色沉淀 | 该溶液可能是烧碱溶液 |
| B | 将硝酸铵固体溶于水 | 溶液温度降低 | 硝酸铵溶于水吸热 |
| C | 向盛有少量固体的试管中滴加稀盐酸 | 产生气泡 | 该固体一定是碳酸盐 |
| D | 点燃某气体,在火焰上方罩一个干冷的烧杯 | 烧杯内壁出现水珠 | 该气体含氢元素 |
| A. | A | B. | B | C. | C | D. | D |
 实验小组探究盐酸和氢氧化钠反应过程中溶液pH及溶液温度变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液pH及溶液温度变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )| A. | t2点时刻的溶液能使酚酞试液变红 | |
| B. | 该化学反应发生时需要从外界吸热 | |
| C. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| D. | t3点时刻溶液中的溶质只有氯化钠 |
| A. | NaOH,Mg(OH)2,HCl | B. | BaCl2,AgNO3,HNO3 | ||
| C. | CaCl2,K2CO3,HCl | D. | CuSO4,NaOH,H2SO4 |
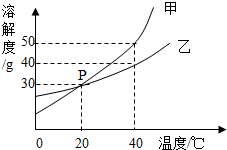 甲、乙两种固体物质的溶解度曲线如图所示.
甲、乙两种固体物质的溶解度曲线如图所示.
 是某元素的原子结构示意图,它的最外层电子数为6,所对应的离子符号为S2-.
是某元素的原子结构示意图,它的最外层电子数为6,所对应的离子符号为S2-.