题目内容
8.液化气是生活中常用燃料,如图是液化气燃气灶具的示意图.
(1)如图所标物件中含有的金属单质是Cu(写化学式).
(2)当燃气灶的火焰呈现黄色或橙色,锅底出现黑色,此时就需要增大(填“增大”或“减小”)灶具的进风口.
(3)写出一种防止钢瓶生锈的方法喷漆.
(4)关闭阀门,燃着的煤气立即熄灭,这种灭火方法体现的灭火原理是清除可燃物.
分析 (1)根据物质的分类来分析;
(2)根据促进可燃物燃烧的方法来分析;
(3)铁与水、氧气同时接触时容易生锈;
(4)根据燃烧的条件分析灭火的原理.
解答 解:(1)塑料属于有机合成材料,钢属于合金,铜属于金属单质;故填:Cu;
(2)燃气灶的火焰呈现黄色或橙色,锅底出现黑色,说明氧气不足,燃气燃烧不充分,此时可将灶具的进风口调大,这样做的目的是增加进入空气(或氧气)的量,使燃气燃烧更充分.故填:增大;
(3)喷漆可以隔绝铁与氧气、水的接触,能够防止钢瓶生锈.故填:喷漆.
(4)关闭煤气阀门熄灭燃气灶,其灭火原理是撤离可燃物,故填:清除可燃物.
点评 化学来源于生产、生活,也服务于生产、生活,因此要学好化学知识,为生产、生活服务.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
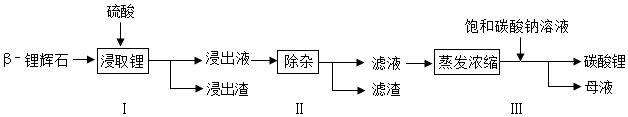
16.密闭容器中盛有CH4和O2的混合气体,点燃使其充分反应,CH4全部转化为CO、CO2和H2O,待容器恢复至室温,测得容器内混合气体中碳元素的质量分数为36%.则反应前CH4和O2的质量比为( )
| A. | 4:13 | B. | 3:10 | C. | 2:7 | D. | 1:4 |
3.小明将一定量铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.下列对滤渣组成的分析,不可能出现的一组是( )
| A. | Ag | B. | Ag 和 Zn | C. | Cu 和 Ag | D. | Cu、Zn 和 Ag |
13.下列事实与解释相符的是( )
| A. | 氧气可用于炼钢--氧气具有可燃性 | |
| B. | 煤矿的矿井要通风、严禁烟火--可燃性气体遇明火发生爆炸 | |
| C. | 进入久未开启的菜窖,要先做灯火试验--二氧化碳有毒 | |
| D. | 铝制品比铁制品耐腐蚀--铝比铁化学性质稳定 |
20.下列物质的用途错误的是( )
| A. |  聚乙烯塑料做电线外皮 | B. |  酱油中添加铁元素 | ||
| C. |  石灰石做建筑材料 | D. |  木炭吸附一些食品里的色素 |
17.下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:
[提出问题 1]:
该氢氧化钠固体有没有变质呢?
[进行实验 1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到产生白色沉淀,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题 2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验 2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
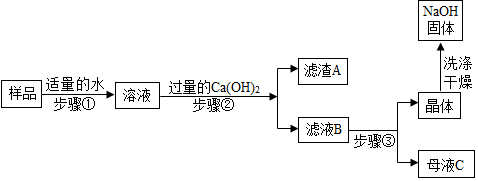
[实验分析]:
(1)步骤②反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,步骤②的操作有搅拌 和过滤,搅拌的作用是使碳酸钠完全反应.
(2)证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是ac.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
(3)为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、B、过滤. A.蒸发结晶B.降温结晶
(4)丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是A.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
(5)表中第2、4次恰好完全反应.
(6)请计算样品中氢氧化钠的质量分数?(请保留具体解题过程)
[提出问题 1]:
该氢氧化钠固体有没有变质呢?
[进行实验 1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到产生白色沉淀,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题 2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验 2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.

[实验分析]:
(1)步骤②反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,步骤②的操作有搅拌 和过滤,搅拌的作用是使碳酸钠完全反应.
(2)证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是ac.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
(3)为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、B、过滤. A.蒸发结晶B.降温结晶
(4)丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是A.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
(6)请计算样品中氢氧化钠的质量分数?(请保留具体解题过程)