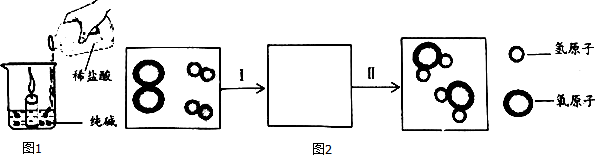
题目内容
17.下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:[提出问题 1]:
该氢氧化钠固体有没有变质呢?
[进行实验 1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到产生白色沉淀,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题 2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验 2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
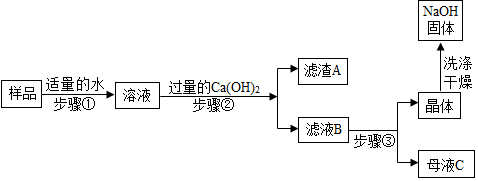
[实验分析]:
(1)步骤②反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,步骤②的操作有搅拌 和过滤,搅拌的作用是使碳酸钠完全反应.
(2)证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是ac.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
(3)为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、B、过滤. A.蒸发结晶B.降温结晶
(4)丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是A.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
(6)请计算样品中氢氧化钠的质量分数?(请保留具体解题过程)
分析 [进行实验 1]:
氢氧化钠能和二氧化碳反应生成碳酸钠和水,碳酸钠能和氯化钡反应生成碳酸钡沉淀和氯化钠;
[实验分析]:
(1)步骤②中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
步骤②的操作有搅拌和过滤,搅拌能使碳酸钠完全反应;
(2)二氧化碳能和氢氧化钙反应生成白色沉淀碳酸钙和水;
(3)为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、降温结晶、过滤;
(4)丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源;
(5)根据表中提供的信息可以判断那组恰好完全反应;
(6)根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:[进行实验 1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到产生白色沉淀,证明氢氧化钠固体已经含有 Na2CO3.
故填:产生白色沉淀.
[实验分析]:
(1)步骤②中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式是:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
步骤②的操作有搅拌 和过滤,搅拌的作用是使碳酸钠完全反应.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;使碳酸钠完全反应.
(2)a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊,说明氢氧化钙溶液过量;
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊,不能说明氢氧化钙溶液过量,也可能是恰好完全反应;
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊,说明氢氧化钙溶液过量.
故选:ac.
(3)为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、降温结晶、过滤.
故填:降温结晶.
(4)丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
故选:A.
(5)由第2次和第3次可知,第3次中样品溶液过量,由第1次和第2次数据可知,第1次氯化钡溶液过量,因此表中第2次恰好完全反应,又因为第4次和第2次两种溶液质量比相等,因此第4次也恰好完全反应.
故填:2、4.
(6)因为第2次恰好完全反应,因此以第2次数据进行计算:
设20g样品溶液中碳酸钠质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106 197
x 3.94g
$\frac{106}{x}$=$\frac{197}{3.94g}$,
x=2.12g,
20g样品溶液中样品质量为:20g×$\frac{19g}{100g}$×100%=3.8g,
样品中氢氧化钠的质量分数为:$\frac{3.8g-2.12g}{3.8g}$×100%=44.2%,
答:样品中氢氧化钠的质量分数为44.2%.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案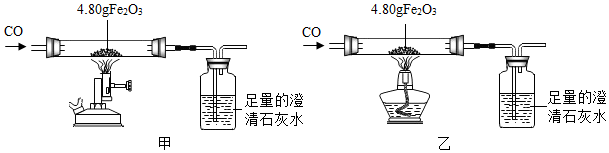
(1)从实验安全角度考虑,图示装置还应采取的改进措施是导管后放点燃的酒精灯或在导管后扎气球.
(2)完全反应后,两组的生成物均为黑色粉未(纯净物),分别用两组生成物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 称量黑色粉末质量/g | m1 | m2 |
| 2 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
| 3 | 取黑色粉未,加入稀盐酸 | 全部溶解,有大量气泡 | 无明显现象 |
| 4 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质生成 | 无明显现象 |
②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为Fe3O4.他又发现m2恰好为4.64g,这可成为支持上述猜想的新证据.
(3)甲、乙两组实验说明温度对CO和Fe2O3反应影响,且均体现出CO的还原性(填写化学性质).
(1)空气
①空气属于混合物(填“混合物”或“纯净物”).
空气中氧气的体积分数约为21%
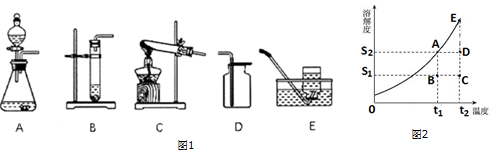
②实验室用高锰酸钾制取氧气时,发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,发生装置可选用以下如图1那个装置C(填装置标号).因为氧气不易溶于水,所以可以利用装置E(填装置标号)收集.如果要做铁丝在氧气中燃烧的实验,用这种装置收集氧气时应注意瓶内应留少量的水.
(2)二氧化碳
①降温将二氧化碳制成干冰,这一过程发生物理变化(填“物理变化”或“化学变化”).
| 实验I | 实验 II |
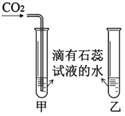 | 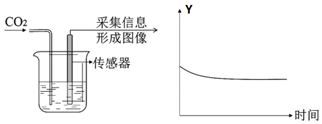 |
③实验II采用“数字化实验”,由传感器采集信息描绘出曲线,其中纵坐标Y可表示为烧杯中的A(填标号).
A.溶液的pH B.溶液的质量 C.二氧化碳体积
(3)水与溶液
①长期饮用硬水对人体健康不利,生活中常用肥皂水来区别硬水和软水.热水壶的内胆常附有水垢(主要成分为碳酸钙和氢氧化镁),下列厨房用品可用于清洗水垢的是
C(填标号).
A.食盐水 B.苏打水 C.食醋
②某固态物质的溶解度曲线如图2所示.
(i)若将C点状态溶液变化为A点,简单的实验操作为降低温度.
(ii)取用任意体积该固态物质饱和溶液时,下列物理量不随所取体积的多少而变化的是CD.
A.溶液中溶质的质量 B.溶液的质量
C.溶液的溶质质量分数 D.溶液的密度.
| A. | 茶氨酸由碳、氢、氧、氮四种元素组成 | |
| B. | 茶树不宜在碱性土壤中生长 | |
| C. | 一个茶氨酸分子中含有3个氧原子 | |
| D. | 茶叶中的锌、硒指单质,茶氨酸属于有机物 |
| A补齐物质与其用途的连线 | B补齐标识与其含义的连线 |
 |  |