题目内容
1.除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是( )| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CaCO3(CaO) | 无 | 高温 |
| B | H2O(植物油) | 洗涤剂 | 振荡、搅拌 |
| C | CuO(铜粉) | 足量氧气 | 灼烧 |
| D | KCl(KClO3) | 二氧化锰 | 加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、CaCO3固体高温煅烧生成氧化钙和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、洗涤剂具有乳化作用,能使植物油分散成细小的液滴形成稳定的乳浊液,不能除去杂质,不符合除杂原则,故选项所采取的方法错误.
C、铜粉与足量氧气灼烧生成氧化铜,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
D、KClO3在二氧化锰的催化作用下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,能除去杂质但引入了新的杂质二氧化锰,不符合除杂原则,故选项所采取的方法错误.
故选:C.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.生产和生活中的有关做法中正确的是( )
| A. | 工业生产中常将煤磨成煤粉 | |
| B. | 图书档案着火时用水基型灭火器扑灭 | |
| C. | 贫血患者应大量服用含铁单质的物质 | |
| D. | 农业生产中将熟石灰和碳酸氢铵混合施用效果好 |
9.推理和归纳是研究和学习化学的重要方法,以下说法正确的是( )
| A. | 分子可以构成物质,所以物质都是由分子构成的 | |
| B. | 离子是带电荷的粒子,所以带电荷的粒子一定是离子 | |
| C. | 因为水电解只产生氢气和氧气,所以水中只含氢、氧两种元素 | |
| D. | 氧化物中肯定含有氧元素,所以含氧元素的化合物一定是氧化物 |
16.有一包白色粉末,其中可能含有BaCl2、CuSO4、NaCl、Na2CO3,为确定该白色粉末的成分,同学们进行了有关实验,实验流程和现象如下:

请回答以下问题.
(1)操作②的名称是过滤,①中发生反应的化学方程式是BaCl2+Na2CO3═BaCO3↓+2NaCl.
(2)通过以上实验可知,此白色粉末中一定含有BaCl2、Na2CO3;一定不含CuSO4,判断的理由是硫酸铜溶液显蓝色、BaCl2和Na2CO3反应产生碳酸钡沉淀.
(3)同学们利用下列两种方案继续对溶液D的成分进行检验,请选择一种方案进行回答.

请回答以下问题.
(1)操作②的名称是过滤,①中发生反应的化学方程式是BaCl2+Na2CO3═BaCO3↓+2NaCl.
(2)通过以上实验可知,此白色粉末中一定含有BaCl2、Na2CO3;一定不含CuSO4,判断的理由是硫酸铜溶液显蓝色、BaCl2和Na2CO3反应产生碳酸钡沉淀.
(3)同学们利用下列两种方案继续对溶液D的成分进行检验,请选择一种方案进行回答.
| 方案一 | 方案二 | |
| 操作 | 取少量溶液D,向其中滴加紫色石蕊溶液,观察到溶液变为红色 | 取少量溶液D,向其中滴加氢氧化钠溶液,无明显现象,再滴加碳酸钠溶液,观察到先有气泡产生,后产生白色沉淀 |
| 结论 | D中所含阳离子一定有 H+ | D中所含阳离子一定有 H+,Ba2+ |
10.下列是初中化学所学习到的物质,其中属于纯净物的是( )
| A. | 干冰 | B. | 可燃冰 | ||
| C. | 净化后的空气 | D. | 高锰酸钾受热分解后的剩余固体 |
11.将Cu-Zn合金粉末放到盛有稀硫酸的烧杯中,恰好完全反应.相关实验数据如表:
(1)生成氢气的质量为0.04g.
(2)若不考虑该合金中除Cu、Zn以外的其它成分.请计算稀硫酸的溶质质量分数.
| Cu-Zn合金的质量/g | 稀硫酸的质量/g | 反应后烧杯内物质的总质量/g |
| 4.0 | 10 | 13.96 |
(2)若不考虑该合金中除Cu、Zn以外的其它成分.请计算稀硫酸的溶质质量分数.

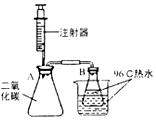 学习小组用如图裝置探究二氧化碳与氢氧化钠的反应.
学习小组用如图裝置探究二氧化碳与氢氧化钠的反应.