题目内容
7.可以证明烧杯中的溶液是硝酸钾饱和溶液的方法是( )| A. | 蒸发1g水,有少量固体析出 | |
| B. | 降低温度,有少量固体析出 | |
| C. | 加入少量硝酸钾固体,固体不再溶解 | |
| D. | 升高温度,没有固体析出 |
分析 本题考查饱和溶液的证明方法,在一定温度下,饱和溶液中一定量的溶剂里溶质的溶解已达到最大限度.
解答 解:A、对不饱和溶液来说,通过蒸发也可能会由饱和变为饱和,然后有固体析出,故A错误.
B、降温有固体析出,原溶液可能是饱和溶液,也可能是不饱和溶液,温度改变,在一定量溶剂里溶解的溶质的量发生变化,故B错误.
C、在不其它条件的前提下,饱和溶液已经不能再溶解溶质,故C正确.
D、硝酸钾的溶解度随温度升高而增大,温度越高,溶解的越多,饱和溶液可变成不饱和溶液,故D错误.
故选:C.
点评 确定溶液是饱和溶液应注意前提条件是在不改变温度和溶剂时,溶质不能够再溶解的溶液,当改变温度或溶剂时,溶解能力将发生变化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16. 如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )
如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )
 如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )
如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )| A. | 20℃时,三种物质的溶解度由大到小的顺序是B>A=C | |
| B. | 50℃时,把50g A放入50 g水中能形成100g A的饱和溶液 | |
| C. | 将C的饱和溶液变为不饱和溶液,可采用降温或加水的方法 | |
| D. | 分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是B>A>C |
17.构成物质的微粒有多种,下列关于微粒的叙述不正确的是( )
| A. | 常温下,二氧化氮为红棕色气体,因此构成他们的分子也为红棕色 | |
| B. | 绝大数的盐是由金属阳离子和酸根阴离子构成,因此盐类物质属于离子化合物 | |
| C. | 稀盐酸和氢氧化钡反应的实质是氢离子与氢氧根离子反应生成水的过程 | |
| D. | 二氧化硅结构与金刚石相似,因此二氧化硅也是由原子构成的 |

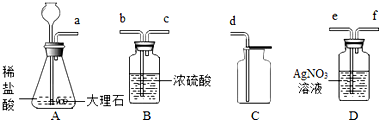

 兴趣小组欲测定某未知溶液Ba(OH)2溶液的溶质质量分数,请你和他们一起完成实验并回答有关问题.
兴趣小组欲测定某未知溶液Ba(OH)2溶液的溶质质量分数,请你和他们一起完成实验并回答有关问题.