题目内容
20.粗盐中含少量Ca2+、Mg2+、SO42-和泥沙等杂质,某同学将利用下列仪器对粗盐进行提纯.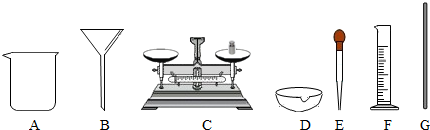
(1)粗盐精制的过程中涉及常规操作步骤有:)①加水溶解;②依次加入过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加入适量的稀盐酸(填试剂名称);⑤浓缩蒸发、冷却结晶.
(2)过滤用到的以上玻璃仪器中:ABG.
(3)利用提纯后的NaCl配置50g7%的NaCl溶液,需要NaCl3.5g;在准确称取固体后,用量筒取水时,仰视读数,则所配置溶液溶质质量分数时偏低(填“偏高”或“偏低”)
分析 (1)依次加入过量的BaCl2、NaOH、Na2CO3溶液时,氯化钡能够除去硫酸根离子,氢氧化钠能够除去镁离子,碳酸钠能够除去钙离子和过量的钡离子;
稀盐酸能和氢氧化钠、碳酸钠反应;
(2)过滤需要烧杯、漏斗和玻璃棒等;
(3)溶质质量=溶液质量×溶质质量分数.
解答 解:(1)粗盐精制的过程中涉及常规操作步骤有:加水溶解,依次加入过量的BaCl2、NaOH、Na2CO3溶液,过滤除去沉淀,加入适量的稀盐酸除去过量的氢氧化钠和碳酸钠,浓缩蒸发、冷却结晶.
故填:稀盐酸.
(2)过滤需要烧杯、漏斗和玻璃棒等.
故填:ABG.
(3)配置50g7%的NaCl溶液,需要NaCl质量为:50g×7%=3.5g;
在准确称取固体后,用量筒取水时,仰视读数会导致量取的水偏多,进一步导致所配置溶液溶质质量分数偏低.
故填:3.5;偏低.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
11.下列物质的化学式的写法和读法正确的是( )
| A. | FeCl2读作氯化铁 | B. | ClNa读作氯化钠 | C. | AgCl读作氯化银 | D. | AlCl2读作氯化铝 |
8. 小明已通过基础实验6-“粗盐的提纯”除去了难溶性杂质,查阅资料发现,实验得到的“精盐”中还含有MgCl2、Na2SO4和CaCl2可溶性杂质,他称取了一定量的“精盐”,并设计了如下实验流程再进行除杂提纯,进一步得到较纯净的NaCl固体.下列说法正确的事( )
小明已通过基础实验6-“粗盐的提纯”除去了难溶性杂质,查阅资料发现,实验得到的“精盐”中还含有MgCl2、Na2SO4和CaCl2可溶性杂质,他称取了一定量的“精盐”,并设计了如下实验流程再进行除杂提纯,进一步得到较纯净的NaCl固体.下列说法正确的事( )
 小明已通过基础实验6-“粗盐的提纯”除去了难溶性杂质,查阅资料发现,实验得到的“精盐”中还含有MgCl2、Na2SO4和CaCl2可溶性杂质,他称取了一定量的“精盐”,并设计了如下实验流程再进行除杂提纯,进一步得到较纯净的NaCl固体.下列说法正确的事( )
小明已通过基础实验6-“粗盐的提纯”除去了难溶性杂质,查阅资料发现,实验得到的“精盐”中还含有MgCl2、Na2SO4和CaCl2可溶性杂质,他称取了一定量的“精盐”,并设计了如下实验流程再进行除杂提纯,进一步得到较纯净的NaCl固体.下列说法正确的事( )| A. | 操作a、操作b和操作c相同,都为过滤 | |
| B. | 若X、Y、Z分别为NaOH、BaCl2、Na2CO3,则溶液N中的溶质为CaCl2 | |
| C. | 若Z为Na2CO3,则白色固体III一定为BaCO3和CaCO3 | |
| D. | 加入过量的稀盐酸的目的是除去过量的Na2CO3 |
15.试评价下列反应式,并判断其反应类型,选择合适的序号填入下表.
评价序号:A.完全正确 B.违背事实 C.没有配平 D.箭头不当
类型序号:①分解反应 ②化合反应.
| 题号 | 反应式 | 评价 | 反应类型 |
| (1) | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | B | ① |
| (2) | P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | C | ② |
类型序号:①分解反应 ②化合反应.
5.蛋白质是人体必需的重要营养成分之一.下列食物中,蛋白质含量较高的是( )
| A. | 豆腐 | B. | 西红柿 | C. | 苹果 | D. | 馒头 |
9.能将氢氧化钠溶液、盐酸、食盐水一次性区分开来的试剂是( )
| A. | 无色酚酞试液 | B. | 镁条 | C. | 紫色石蕊试液 | D. | 碳酸钠 |
