题目内容
12.为配制20℃时的饱和氯化钠溶液,并粗略测定此温度下氯化钠的溶解度,其化学小组进行了下列实验.①称取20.0g氯化钠固体;
②20℃时,量取50mL水倒入烧杯中;
③将氯化钠逐步加入水中,用玻璃棒搅拌,至不能溶解;
④分离出未溶解的氯化钠,并称得所有剩余氯化钠质量为2.0g.
分析上述实验过程并回答下列问题:
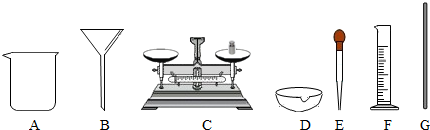
(1)实验中不会使用到下列仪器中的A(填序号).

(2)步骤③中,玻璃棒的作用是加速氯化钠的溶解.
(3)步骤④中,分离出未溶解氯化钠的操作名称是过滤.
(4)经过实验,20℃时,氯化钠在水中的溶解度为36g.
(5)步骤②中,若量取水时,仰视量筒读数,将导致所配饱和氯化钠溶液溶质的质量分数无影响(填“偏大”“偏小”或“无影响”).
分析 (1)根据实验的过程和操作分析用不到的仪器;
(2)根据在溶解过程中玻璃棒的应用分析回答;
(3)根据溶解度的定义和在50mL水中达到饱和时溶解氯化钠的质量分析计算;
(4)根据过滤的原理分析回答;
(5)根据配制饱和氯化钠溶液的操作方法分析仰视读数对溶质的质量分数的影响.
解答 解:(1)由实验的操作过程可知,在称取20.0g氯化钠固体时用到了图中仪器的托盘天平,量取水时用到了图中仪器的量筒和胶头滴管;溶解时用到了图中仪器的烧杯和玻璃棒,分离未溶解的氯化钠时用到了仪器中的漏斗,整个实验中未用到的仪器是酒精灯;
(2)在溶解过程中用玻璃棒搅拌,作用是加速氯化钠的溶解;
(3)由于过滤能将固液分离,所以步骤④中,分离出未溶解氯化钠的操作名称是过滤.
(4)由实验可知,20℃时,在50mL的水中达到饱和溶解了20g-2g=18g氯化钠;所以该温度下,在100g的水中能溶解36g氯化钠,所以,20℃时,氯化钠在水中的溶解度为36g.
(5)配置过程中,若量取水时,仰视量筒读数,实际所量取的水偏多,但是在实验中是配制饱和溶液,配制的方法是加入氯化钠至不再溶解为止,所以对所配饱和氯化钠溶液溶质的质量分数无影响.
故答为:(1)A;(2)加速氯化钠的溶解;(3)过滤;(4)36g;(5)无影响.
点评 此题是对溶液知识的考查,了解配制溶液的操作、固体溶解度的概念和溶质质量分数计算方法是解答本题的基础知识,在计算时弄清溶液中溶质、溶剂和溶液的质量关系是计算的关键.

练习册系列答案
相关题目
3.下列标志表示禁止烟花的是( )
| A. |  | B. |  | C. |  | D. |  |