题目内容
某工业生产上规定空气中二氧化硫的允许排放量不得超过0.02mg/m3.某研究性学习小组利用“碘量法”测定某化工厂附近空气中的二氧化硫的含量,请你参与并协助他们完成相关学习任务.
【查阅资料】淀粉遇碘(I2)变蓝,遇氢碘酸(HI)不变色.氢碘酸为无色液体.
【测定原理】
碘溶液吸收SO2的化学反应原理是:SO2+I2+2H2O═X+2HI.X的化学式为 .
【测定步骤】
(1)取配制好的碘(I2)溶液5.00mL(含I2的质量为6.35×10-4 mg)于下述装置中的反应容器内,并滴加2-3滴无色淀粉溶液.
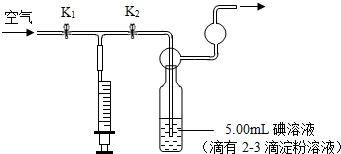
(2)利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数.抽气时应进行的操作是 .实验中表明恰好完全反应的现象是 .
(3)换到不同地点再重复实验4次(每次所取碘溶液相同).这样做的目的是 .
每次实验的抽气次数记录 如表.
【得出结论】
【交流与讨论】
实验结束后,有同学提议:可将插入碘溶液的导管下端改成具有多孔的球泡,有利于提高实验的准确度,其理由是 .
【查阅资料】淀粉遇碘(I2)变蓝,遇氢碘酸(HI)不变色.氢碘酸为无色液体.
【测定原理】
碘溶液吸收SO2的化学反应原理是:SO2+I2+2H2O═X+2HI.X的化学式为
【测定步骤】
(1)取配制好的碘(I2)溶液5.00mL(含I2的质量为6.35×10-4 mg)于下述装置中的反应容器内,并滴加2-3滴无色淀粉溶液.

(2)利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数.抽气时应进行的操作是
(3)换到不同地点再重复实验4次(每次所取碘溶液相同).这样做的目的是
每次实验的抽气次数记录 如表.
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 抽气次数 | 42 | 38 | 36 | 44 | 40 |
| 二氧化硫的含量 | 是否超标 |
实验结束后,有同学提议:可将插入碘溶液的导管下端改成具有多孔的球泡,有利于提高实验的准确度,其理由是
考点:实验探究物质的组成成分以及含量,质量守恒定律及其应用,根据化学反应方程式的计算
专题:科学探究
分析:【测定原理】根据质量守恒定律推断x的化学式;
【测定步骤】
(2)先打开K1、关闭K2,用注射器提取室内空气,然后关闭a、打开b,将注射器中的气体压缩到酸性高锰酸钾溶液中;
(3)根据为保证实验结果的准确性,使结果更准确解答;根据题中信息最后计算出1m3空气中含有的二氧化硫的质量,根据空气中二氧化硫含量标准,判断出空气质量情况;
【交流与讨论】
根据有利于提高实验的准确度的方法解答.
【测定步骤】
(2)先打开K1、关闭K2,用注射器提取室内空气,然后关闭a、打开b,将注射器中的气体压缩到酸性高锰酸钾溶液中;
(3)根据为保证实验结果的准确性,使结果更准确解答;根据题中信息最后计算出1m3空气中含有的二氧化硫的质量,根据空气中二氧化硫含量标准,判断出空气质量情况;
【交流与讨论】
根据有利于提高实验的准确度的方法解答.
解答:解:
【测定原理】根据化学反应前后各种原子的原子个数相等可知:
反应前:S:1,H:4,I:2,O:4;
反应后:H:2,I:2;
故X中含有1个硫原子,2个氢原子,4个氧原子,故X的化学式为:H2SO4;
【测定步骤】
(2)先打开K1 关闭K2,用注射器提取室内空气,然后关闭K1、打开K2,将注射器中的气体压缩并注入碘溶液中,如果溶液由蓝色恰好变成无色,则说明恰好完全反应;
(3)为保证实验结果的准确性,使结果更准确,所以应多次测量,取平均值;
由表中数据可知平均每次实验的抽气次数为(42+38+36+44+40)÷5=40
则抽气40次SO2的质量为x,
SO2~~~~~~~~~~~I2
64 254
x 6.35×10-4 mg
=
x=1.6×10-4mg
每L气体中SO2的质量为1.6×10-4mg÷40×100ml×10-6=0.04mg/L=0.04mg/m3,规定空气中二氧化硫的允许排放量不得超过0.02mg/m3
故超标;
【交流与讨论】
将插入碘溶液的管子下端改成具有多孔的球泡,可以增大空气与碘溶液的接触面积,使空气中的二氧化硫反应充分,有利于提高实验的准确度.
答案:
【测定原理】H2SO4
【测定步骤】
(2)关闭k2打开k1,向外拉动注射器 溶液由蓝色恰好变成无色
(3)多次测量,取平均值,使结果更准确
【得出结论】
【交流与讨论】
增大气体与液体的接触面积,使二氧化硫被充分吸收
【测定原理】根据化学反应前后各种原子的原子个数相等可知:
反应前:S:1,H:4,I:2,O:4;
反应后:H:2,I:2;
故X中含有1个硫原子,2个氢原子,4个氧原子,故X的化学式为:H2SO4;
【测定步骤】
(2)先打开K1 关闭K2,用注射器提取室内空气,然后关闭K1、打开K2,将注射器中的气体压缩并注入碘溶液中,如果溶液由蓝色恰好变成无色,则说明恰好完全反应;
(3)为保证实验结果的准确性,使结果更准确,所以应多次测量,取平均值;
由表中数据可知平均每次实验的抽气次数为(42+38+36+44+40)÷5=40
则抽气40次SO2的质量为x,
SO2~~~~~~~~~~~I2
64 254
x 6.35×10-4 mg
| 64 |
| 254 |
| x |
| 6.35×10-4mg |
x=1.6×10-4mg
每L气体中SO2的质量为1.6×10-4mg÷40×100ml×10-6=0.04mg/L=0.04mg/m3,规定空气中二氧化硫的允许排放量不得超过0.02mg/m3
故超标;
【交流与讨论】
将插入碘溶液的管子下端改成具有多孔的球泡,可以增大空气与碘溶液的接触面积,使空气中的二氧化硫反应充分,有利于提高实验的准确度.
答案:
【测定原理】H2SO4
【测定步骤】
(2)关闭k2打开k1,向外拉动注射器 溶液由蓝色恰好变成无色
(3)多次测量,取平均值,使结果更准确
【得出结论】
| 二氧化硫的含量 | 是否超标 |
| 0.04mg/m3 | (2分) 超标 |
增大气体与液体的接触面积,使二氧化硫被充分吸收
点评:本题以空气中甲醛含量测定为载体,考查仪器的选择、对操作的理解分析与评价、对装置的评价、氧化还原反应滴定应用、化学计算等,需要学生具备扎实的基础与运用知识分析、解决问题的能力,侧重对学生能力的考查,兼顾基础知识,难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
科学施用化肥是农业增产的重要手段.下列属于钾肥的是( )
| A、KNO3 |
| B、Ca(H2PO4)2 |
| C、NH4HCO3 |
| D、K2SO4 |
 某化学小组在课外活动时利用如图装置进行实验 (图中铁架台等仪器已略去).
某化学小组在课外活动时利用如图装置进行实验 (图中铁架台等仪器已略去).

 为测定空气中氧气所占的体积分数,某同学设计了如图实验,在一个透明耐热活塞的底部放一小块(足量)白磷,然后迅速将活塞下压,可以观察到的现象为
为测定空气中氧气所占的体积分数,某同学设计了如图实验,在一个透明耐热活塞的底部放一小块(足量)白磷,然后迅速将活塞下压,可以观察到的现象为