题目内容
18. 用如图所示的装置测量空气中氧气的含量.
用如图所示的装置测量空气中氧气的含量.(1)燃烧匙中红磷足量的原因是为了将密闭容器中的氧气消耗尽;有关反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)待装置冷却到室温后,打开弹簧夹,进入集气瓶中液体的体积大于$\frac{1}{5}$,其原因可能是点燃红磷后伸入广口瓶中太慢.
分析 (1)根据化学方程式的书写方法、步骤进行书写即可;根据该实验注意事项分析;
(2)根据造成测得氧气的体积分数小于五分之一的因素可以从以下方面考虑:装置是否漏气;药品的用量是否充足;装置是否冷却到室温;反应是否充分等,据此分析.
解答 解:
(1)红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;实验的目的是测定空气中氧气含量,原理是消耗氧气使装置内外产生压强差,水被吸入占据氧气的空间,从而达到测定氧气的目的,红磷过量,可使集气瓶中的氧气完全消耗;
(2)实验前若没有将弹簧夹夹紧,会导致实验中装置内的气体受热膨胀而逸出,因此测得氧气的体积分数会大于五分之一;实验中可能红磷点燃后伸入集气瓶太慢,会导致实验中装置内的气体受热膨胀而逸出,因此测得氧气的体积分数会大于五分之一.
答案:
(1)为了将密闭容器中的氧气消耗尽 4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$2P2O5
(2)点燃红磷后伸入广口瓶中太慢
点评 熟记用红磷测定空气里氧气含量的实验原理、操作步骤、实验现象、实验结论和注意事项是解答这类题目的基础.

练习册系列答案
相关题目
19.“水晶明珠”是人们对葡萄的爱称.葡萄中含有丰富的白藜芦醇(C14H12O3),它具有抗癌性能,能抑制癌细胞的增生.下列有关白藜芦醇的说法不正确的是( )
| A. | 它的相对分子质量为228 | |
| B. | 该物质中氢元素的质量分数最小 | |
| C. | 它是一种有机化合物 | |
| D. | 它是由14个碳原子、12个氢原子和3个氧原子构成的 |
9.下列各组离子在pH=14的溶液中能大量共存的是( )
| A. | H+、NO3-、Fe2+、Na+ | B. | K+、Ba2+、OH-、NO3- | ||
| C. | Ca2+、CO32-、Cl-、K+ | D. | Cu2+、NH4+、NO3-、Cl- |
6.某气体由氢气、一氧化碳、甲烷中的一种或几种组成.点燃该气体后,在火焰上方罩一冷而干燥的烧杯,烧杯内壁出现水雾;把烧杯迅速倒转过来,注入少量澄清石灰水,振荡,石灰水变混浊.下列对气体组成的推断错误的是( )
| A. | 可能只有氢气一种气体 | B. | 可能三种气体都存在 | ||
| C. | 可能是甲烷和一氧化碳的混合气体 | D. | 可能只有甲烷一种气体 |
13.氯化铵溶液在工农业生产中有着广泛的应用.
某同学向100g水中不断加入固体氯化铵或改变温度,得到相应的溶液①~⑤.
$\stackrel{25℃}{100g水}$$→_{37.2g}^{加入A}$①$→_{4.2g}^{加入A}$②$→_{至60℃}^{升温}$③$→_{9g}^{加入A}$④$→_{至50℃}^{降温}$⑤
试回答:
(1)氯化铵溶液中,溶质是NH4Cl.
(2)上述溶液①~⑤中,属于饱和溶液的是②⑤.[填序号]
(3)上述溶液①~⑤中,溶质质量分数最大的是④⑤.
某同学向100g水中不断加入固体氯化铵或改变温度,得到相应的溶液①~⑤.
$\stackrel{25℃}{100g水}$$→_{37.2g}^{加入A}$①$→_{4.2g}^{加入A}$②$→_{至60℃}^{升温}$③$→_{9g}^{加入A}$④$→_{至50℃}^{降温}$⑤
| 资料:氯化铵的溶解度 | |||||
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
(1)氯化铵溶液中,溶质是NH4Cl.
(2)上述溶液①~⑤中,属于饱和溶液的是②⑤.[填序号]
(3)上述溶液①~⑤中,溶质质量分数最大的是④⑤.
7.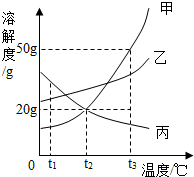 图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
 图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | 升高温度可以将接近饱和的丙溶液变为饱和溶液 | |
| C. | t3℃的甲、丙两物质的饱和溶液降温到t2℃时,所得溶液的溶质质量分数相等 | |
| D. | t2℃时,50g水中加入15g甲物质,所得溶液的溶质质量分数约为16.7% |
8.在AgNO3和Cu(NO3)2的混合液中,加入一定量的铁粉,充分反应后,有少量金属析出,过滤后,向滤液中滴加稀盐酸,有白色沉淀产生,则理论上析出的少量金属是( )
| A. | Ag | B. | Cu | C. | Fe和Cu | D. | Cu和Ag |
 豆腐是生活中常见的食品,主要成分如右图所示.
豆腐是生活中常见的食品,主要成分如右图所示. 腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).
腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).