题目内容
9.下列各组离子在pH=14的溶液中能大量共存的是( )| A. | H+、NO3-、Fe2+、Na+ | B. | K+、Ba2+、OH-、NO3- | ||
| C. | Ca2+、CO32-、Cl-、K+ | D. | Cu2+、NH4+、NO3-、Cl- |
分析 pH为14的水溶液显碱性,水溶液中含有大量的OH-.根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存,据此进行分析判断即可.
解答 解:pH为14的水溶液显碱性,水溶液中含有大量的OH-.
A、Fe2+与碱性溶液中的OH-两种离子能结合成氢氧化亚铁沉淀,H+与碱性溶液中的OH-两种离子能结合成水,不能大量共存,故选项错误.
B、四种离子间不能结合成沉淀、气体或水,能在碱性溶液中大量共存,故选项正确.
C、Ca2+、CO32--两种离子能结合成碳酸钙沉淀,不能大量共存,故选项错误.
D、Cu2+与碱性溶液中的OH-两种离子能结合成氢氧化铜沉淀,NH4+与碱性溶液中的OH-两种离子能结合成氨气和水,不能大量共存,故选项错误.
故选:B.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意在碱性溶液中共存.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
11. 向下表的甲物质中逐渐加入相应的乙物质至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图曲线表示的是( )
向下表的甲物质中逐渐加入相应的乙物质至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图曲线表示的是( )
 向下表的甲物质中逐渐加入相应的乙物质至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图曲线表示的是( )
向下表的甲物质中逐渐加入相应的乙物质至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图曲线表示的是( )| 序号 | 甲 | 乙 |
| ① | HCl和H2SO4的混合酸 | Ba(NO3)2溶液 |
| ② | Cu-Zn合金 | 稀H2SO4 |
| ③ | 生锈的铁钉 | 稀盐酸 |
| ④ | 澄清石灰水 | CO2和HCl混合气体 |
| ⑤ | Na2CO3和NaOH的混合溶液 | 盐酸 |
| A. | ①④ | B. | ③⑤ | C. | ②⑤ | D. | ③④ |
8.实验室为测定某石灰石样品中钙元素含量,取16g石灰石(杂质不含钙元素且不与稀盐酸反应)于烧杯中,再取150g稀盐酸分三次加入,每次充分反应后称量烧杯内剩余物质总质量,数据记录如表:根据实验数据计算:
(1)生成CO2总质量4.4g;
(2)所取样品中碳酸钙质量10g,则样品中钙元素质量分数为25%.
(3)所用稀盐酸的溶质质量分数.
| 第一次 | 第二次 | 第三次 | |
| 稀盐酸质量/g | 50 | 50 | 50 |
| 烧杯内剩余物质总质量/g | 63.8 | 111.6 | 161.6 |
(2)所取样品中碳酸钙质量10g,则样品中钙元素质量分数为25%.
(3)所用稀盐酸的溶质质量分数.
4.下列放出热量的变化过程,有一种不同与其他三种的是( )
| A. | 白磷自燃 | B. | 物质燃烧 | C. | 生石灰吸水 | D. | 电灯通电 |
14.下列关于化学实验操作叙述正确的是( )
| A. | 将试纸直接浸没在溶液中,测定某溶液的pH | |
| B. | 过滤时,漏斗下端的尖嘴部分需紧贴烧杯内壁 | |
| C. | 未说明药品用量时,一般液体取5毫升左右 | |
| D. | 将氢氧化钠固体放在衬有纸片的托盘上称量 |
1.制取漂白粉的化学方程式为:2Ca(OH)2+2Cl2═X+CaCl2+2H2O,其中X是漂白粉的有效成份,X的化学式为( )
| A. | CaO | B. | HCl | C. | CaClO2 | D. | Ca(ClO)2 |

 用如图所示的装置测量空气中氧气的含量.
用如图所示的装置测量空气中氧气的含量.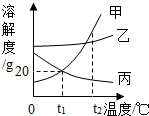 如图所示,依据甲、乙、丙三种固体物质的溶解度曲线,回答下列问题.
如图所示,依据甲、乙、丙三种固体物质的溶解度曲线,回答下列问题.