题目内容
20.下列实验方案能够达到目的是( )| 选项 | 实验内容 | 实验方案 |
| A | 鉴别碳酸钠和大理石粉 | 分别向两种粉末中滴加稀盐酸 |
| B | 鉴别稀盐酸和稀硫酸 | 分别向两种溶液中滴加氯化钡溶液 |
| C | 除去二氧化碳中的水蒸气和氯化氢气体 | 将气体先通过足量氢氧化钠溶液,再通过浓硫酸 |
| D | 除去铁粉中的少量碳粉 | 在空气中加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据物质的性质以及性质差异、物质间的反应进行分析解答即可.
解答 解:A、向碳酸钠和大理石粉末中加入盐酸都会产生气体,现象相同,无法鉴别,错误;
B、向两种溶液中滴加氯化钡溶液,有沉淀产生的是硫酸,无现象的是盐酸,可以鉴别,正确;
C、除去二氧化碳中的水蒸气和氯化氢气体,通过氢氧化钠溶液则二氧化碳也会反应,错误;
D、在空气中加热,则铁粉也会被氧化,错误;
故选B.
点评 鉴别和分离物质,要根据物质的性质差异进行.

练习册系列答案
相关题目
8.下列各组依据实验目的设计的实验方案中合理的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 验证某可燃性气体中含有H2 | 点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁是否出现液滴 |
| B | 除去NaCl中的Na2SO4 | 加水溶解,再加过量BaCl2溶液后过滤、蒸发、结晶 |
| C | 鉴别化肥KNO3和NH4Cl | 取样与熟石灰混合研磨,闻气味 |
| D | 检验NaOH是否变质 | 加水溶解,滴加足量的稀盐酸,观察是否产生气泡等(合理即可) |
5.从微观角度对下列现象的解释中不正确的是( )
| 选项 | 现象 | 微观解释 |
| A | 两块表面平滑的铅块紧压后会结合起来 | 分子间存在引力 |
| B | 尘土飞扬 | 分子在不断运动 |
| C | 食物腐烂 | 分子本身发生变化 |
| D | 敞口放置的盐酸变稀 | 分子在不断运动 |
| A. | A | B. | B | C. | C | D. | D |
12.玻璃棒在化学实验中有多种用途,下列实验操作不需要用玻璃棒的是( )
| A. | 用过氧化氢溶液制氧气 | B. | 溶解食盐固体 | ||
| C. | 过滤浑浊液 | D. | 检验某溶液的pH值 |
9.如图是X、Y、Z、W四种溶液的近似pH,下列判断中不正确的是( )
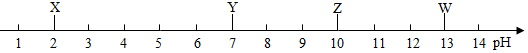

| A. | X一定显酸性 | B. | Y一定是水 | ||
| C. | Z不一定是碱溶液 | D. | W的碱性一定比Z强 |
14.(1)为证明中和反应是放热反应,某小组进行了如图所示的实验操作: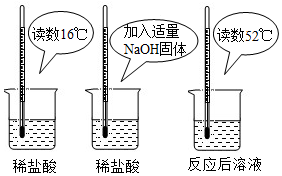
根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是氢氧化钠固体溶于水放热.丙同学认为:通过多个实验才能得出一个普遍的结论.请你再举出一个酸碱中和反应的实例,写出反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O.
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
【实验结论】影响中和反应放出热量多少的因素是反应物的浓度.
【交流反思】反应后,烧杯内溶液pH最小的是E(填烧杯编号).
(3)若要使40g20%的氢氧化钠溶液恰好完全中和,则需要10%的盐酸溶液多少克?(根据化学方程式列式计算)

根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是氢氧化钠固体溶于水放热.丙同学认为:通过多个实验才能得出一个普遍的结论.请你再举出一个酸碱中和反应的实例,写出反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O.
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
【交流反思】反应后,烧杯内溶液pH最小的是E(填烧杯编号).
(3)若要使40g20%的氢氧化钠溶液恰好完全中和,则需要10%的盐酸溶液多少克?(根据化学方程式列式计算)