题目内容
某Fe3O4样品中中可能含有的杂质是Fe2O3和FeO其中的一种.为探究杂质的情况设计如下方案: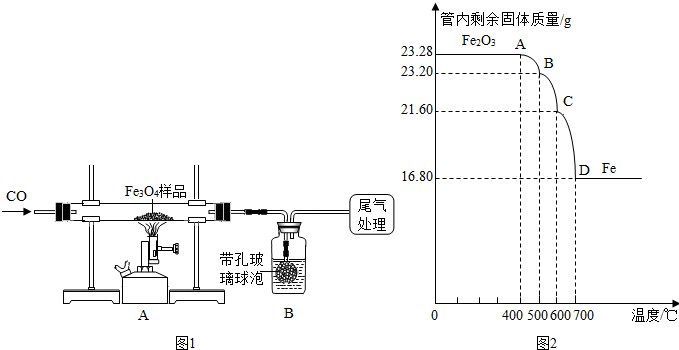
【实验设计】同学们称取了23.28g该Fe3O4样品用图一进行了下列实验:(友情提示:带孔玻璃球泡可以使液体和气体充分接触)
【实验分析】因探究思路不同,兴趣小组分成甲、乙、丙三个讨论小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是 ; (填序号).
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO的作用有 (填序号)
①CO气体作为反应物
②实验开始时,排尽装置中的空气,防止加热时发生爆炸
③停止加热后,防止A中生成物被氧化
④停止加热后防止B中的溶液倒吸入A中
⑤对B中反应物起到一定的搅拌作用,便于CO2与反应液充分接触而反应
乙组:
乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是 ;改进为:在B装置后接一盛有 (填试剂名称)的广口瓶的吸水装置,将B和该装置“捆绑”称量,从而减小误差.
丙组:
丙组同学将B中液体改换为Ba(OH)2溶液,通过测量生成的 (填化学式)沉淀的质量来计算求解,为了获得沉淀,该组同学需要进行的操作有:过滤→ → →称量.
【查阅资料】
Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图二).
(1)写出BC段发生反应的化学方程式: ;
(2)确定:该Fe3O4样品中含有的杂质是 ,其中含Fe3O4的质量是 g,(不需要写出过程)
(已知Fe3O4、FeO、Fe2O3中铁元素质量分数分别为72.4%、77.8%、70.0%)

【实验设计】同学们称取了23.28g该Fe3O4样品用图一进行了下列实验:(友情提示:带孔玻璃球泡可以使液体和气体充分接触)
【实验分析】因探究思路不同,兴趣小组分成甲、乙、丙三个讨论小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO的作用有
①CO气体作为反应物
②实验开始时,排尽装置中的空气,防止加热时发生爆炸
③停止加热后,防止A中生成物被氧化
④停止加热后防止B中的溶液倒吸入A中
⑤对B中反应物起到一定的搅拌作用,便于CO2与反应液充分接触而反应
乙组:
乙组同学认为B装置反应前后的质量差会偏小而影响计算、分析,你认为他们的理由是
丙组:
丙组同学将B中液体改换为Ba(OH)2溶液,通过测量生成的
【查阅资料】
Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图二).
(1)写出BC段发生反应的化学方程式:
(2)确定:该Fe3O4样品中含有的杂质是
(已知Fe3O4、FeO、Fe2O3中铁元素质量分数分别为72.4%、77.8%、70.0%)
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,一氧化碳还原氧化铁,化合物中某元素的质量计算
专题:科学探究
分析:【实验分析】甲组:(1)根据氢氧化钠溶液用于吸收二氧化碳进行解答;(2)根据一氧化碳还原四氧化三铁的作用进行解答;
乙组:根据一氧化碳从B装置中流出要带走水蒸气进行解答;
丙组:据二氧化碳与氢氧化钡反应生成碳酸钡沉淀考虑;
【查阅资料】
(1)根据反应进行程度判断;(2)根据氧元素的含量进行判断.
乙组:根据一氧化碳从B装置中流出要带走水蒸气进行解答;
丙组:据二氧化碳与氢氧化钡反应生成碳酸钡沉淀考虑;
【查阅资料】
(1)根据反应进行程度判断;(2)根据氧元素的含量进行判断.
解答:解:【实验分析】甲组:(1)氢氧化钙的溶解性很小,不能保证把生成的二氧化碳全部吸收;二氧化碳溶解水的能力也不大,不能保证把生成的二氧化碳全部吸收;稀盐酸和二氧化碳不反应;只有氢氧化钠溶液保证把生成的二氧化碳全部吸收,故选用氢氧化钠浓溶液;
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:实验开始时,排尽装置中的空气,防止加热时发生爆炸;停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;将装置中的CO2送入NaOH溶液中;对B中反应物起到一定的搅拌作用,便于CO2与反应液充分接触而反;故答案①②③④⑤
乙组:CO从B中溶液里逸出时会带出部分水蒸气,而影响计算样品中杂质的质量;浓硫酸具有吸水性,可作干燥剂;
丙组:二氧化碳与氢氧化钡反应生成碳酸钡沉淀;为获得纯净的碳酸钡可进行以下操作:过滤→洗涤→干燥→称量.
【查阅资料】
(1)BC段发生反应的化学方程式:Fe3O4+CO
3FeO+CO2;
(2)到700℃时只剩下铁,即此时氧化铁被一氧化碳还原为铁单质.
则混合物中铁元素的质量分
×100%=72.16%
而Fe3O4铁元素的质量分数
×100%=72.4%
FeO铁元素的质量分数
×100%≈77.8%
Fe2O3铁元素的质量分
×100%=70%
所以该Fe3O4样品中含有的杂质是Fe2O3.
设混合物中含Fe3O4的质量为x.x×
×100%+(23.28-x)×
×100%=16.80g
解得:x=20.88g.
故答案为:(1)②
(2)①②③④⑤
乙组:CO从B中溶液里逸出时会带出部分水蒸气.浓硫酸 BaCO3
洗涤 干燥
(3)Fe3O4+CO
3FeO+CO2 Fe2O3 20.88g
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:实验开始时,排尽装置中的空气,防止加热时发生爆炸;停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;将装置中的CO2送入NaOH溶液中;对B中反应物起到一定的搅拌作用,便于CO2与反应液充分接触而反;故答案①②③④⑤
乙组:CO从B中溶液里逸出时会带出部分水蒸气,而影响计算样品中杂质的质量;浓硫酸具有吸水性,可作干燥剂;
丙组:二氧化碳与氢氧化钡反应生成碳酸钡沉淀;为获得纯净的碳酸钡可进行以下操作:过滤→洗涤→干燥→称量.
【查阅资料】
(1)BC段发生反应的化学方程式:Fe3O4+CO
| ||
(2)到700℃时只剩下铁,即此时氧化铁被一氧化碳还原为铁单质.
则混合物中铁元素的质量分
| 16.8g |
| 23.28g |
而Fe3O4铁元素的质量分数
| 56×3 |
| 56×3+16×4 |
FeO铁元素的质量分数
| 56 |
| 56+16 |
Fe2O3铁元素的质量分
| 56×2 |
| 56×2+16×3 |
所以该Fe3O4样品中含有的杂质是Fe2O3.
设混合物中含Fe3O4的质量为x.x×
| 56×3 |
| 56×3+16×4 |
| 56×2 |
| 56×2+16×3 |
解得:x=20.88g.
故答案为:(1)②
(2)①②③④⑤
乙组:CO从B中溶液里逸出时会带出部分水蒸气.浓硫酸 BaCO3
洗涤 干燥
(3)Fe3O4+CO
| ||
点评:本题考查一氧化碳还原铁的氧化物的步骤、现象、化学反应式的书写,以及用不同的方法验证铁的存在,需要同学们具有比较全面的化学知识

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
 化学就在我们身边,它与我们的生活息息相关.
化学就在我们身边,它与我们的生活息息相关.