题目内容
我们城市生活用的自来水是经自来水厂通过对天然水进行 、 、 等处理,使之达到饮用水的标准,其净化过程如图所示:
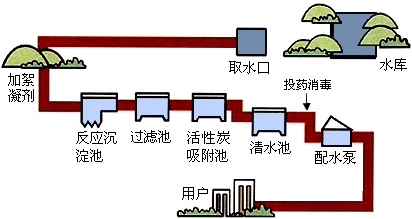
(1)在吸附池里利用活性炭的 性除去异味和有色物质.
(2)清水池里的水是纯水吗,为什么? ;如果自来水在传输过程中存在细菌污染,在饮用该水之前应该怎样处理?方法是 .
(3)面临淡水资源的短缺,有人提倡“一水多用”,请你举出生活中的一项具体措施 .

(1)在吸附池里利用活性炭的
(2)清水池里的水是纯水吗,为什么?
(3)面临淡水资源的短缺,有人提倡“一水多用”,请你举出生活中的一项具体措施
考点:自来水的生产过程与净化方法,碳单质的物理性质及用途,保护水资源和节约用水
专题:空气与水
分析:根据净化水的过程解答;
(1)根据活性炭的吸附性解答;
(2)清水池里含有可溶性杂质,不是纯水,通入氯气消毒可以杀死细菌;
(3)根据生活中一水多用的例子进行解答.
(1)根据活性炭的吸附性解答;
(2)清水池里含有可溶性杂质,不是纯水,通入氯气消毒可以杀死细菌;
(3)根据生活中一水多用的例子进行解答.
解答:解:自来水厂通过对天然水进行沉降、过滤、消毒等处理,达到饮用水的标准;
(1)活性炭的具有吸附性可以除去异味和有色物质;
(2)清水池里含有可溶性杂质,不是纯水,通入氯气消毒可以杀死细菌;
(3)生活中一水多用的例子有很多,例如用淘米的水浇花,洗衣的水冲厕所等.
答案:沉降、过滤、消毒;(1)吸附;(2)不是纯水,含有可溶性杂质;通入氯气消毒;(3)用淘米的水浇花.
(1)活性炭的具有吸附性可以除去异味和有色物质;
(2)清水池里含有可溶性杂质,不是纯水,通入氯气消毒可以杀死细菌;
(3)生活中一水多用的例子有很多,例如用淘米的水浇花,洗衣的水冲厕所等.
答案:沉降、过滤、消毒;(1)吸附;(2)不是纯水,含有可溶性杂质;通入氯气消毒;(3)用淘米的水浇花.
点评:本题就考查的内容来看不算难,但是由于涉及的内容和问题都多,解答时一定要仔细,尤其是离子的符号要严格按照规定书写规范,节约用水的环保思想更要正确.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
在学习过程中,总结规律要严谨、全面、科学.下列总结出的规律不正确的是( )
| A、一种元素只能组成一种单质 |
| B、含氧元素的化合物不一定是氧化物 |
| C、碱和氧化物一定含有氧元素 |
| D、酸性溶液中一定含有氢离子 |
下列有关实验现象描述正确的是( )
| A、碳在氧气中燃烧发出蓝紫色的光 |
| B、木炭在氧气中剧烈燃烧发出白光 |
| C、镁条在空气中剧烈燃烧,生成黑色固体 |
| D、红磷在氧气中燃烧产生大量白色烟雾 |
 A、B、C、D是初中化学常见物质,若A、B、C、D之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件均已略去)A、D均含相同元素,且A、B、D均为氧化物,C是单质.
A、B、C、D是初中化学常见物质,若A、B、C、D之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件均已略去)A、D均含相同元素,且A、B、D均为氧化物,C是单质.