题目内容
5. 某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0克石灰石样品,平均分成两份,一份为块状,另一份加工成粉末状;
②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示.
化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑
请回答:
(1)由图中曲线分析得出,影响该化学反应速率的因素是反应物的接触面积.
(2)每份样品充分反应后,生成二氧化碳的质量为4.4g.
(3)求该样品中碳酸钙的质量分数.
分析 根据生成二氧化碳的质量与反应时间的关系图,样品充分反应后,二氧化碳质量不再随反应时间延长而增加,此时所得二氧化碳质量为4.4g;由生成二氧化碳的质量,根据反应的化学方程式,可计算出样品中碳酸钙的质量,进而可计算出样品中的碳酸钙的质量分数.
解答 解:(1)由图中曲线分析,块状和粉末状的碳酸钙在与盐酸反应时,与盐酸的接触面积不同,粉末状的碳酸钙与盐酸接触面积大,反应快;于是得出影响该化学反应速率的因素是:反应物的接触面积;
(2)根据关系图可知,样品充分反应后,生成二氧化碳的质量为4.4g;
(3)设石灰石样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
x=10.0g
石灰石样品中碳酸钙的质量分数为:$\frac{10g}{12.5g}$×100%=80%.
故答案为:(1)反应物的接触面积;
(2)4.4g;
(3)80%.
点评 解答这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,然后根据所给的问题情景结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
13.“2H”表示的意义是( )
| A. | 表示两种氢元素 | |
| B. | 表示两个氢元素 | |
| C. | 表示两个氢原子 | |
| D. | 既表示两个氢元素,又表示两个氢原子 |
20.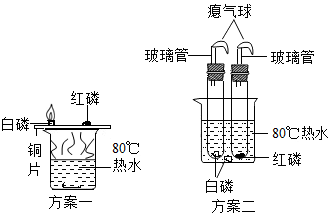 某化学小组想研究燃烧的条件,设计了如图二个实验方案,下列关于方案设计说法不合理的是( )
某化学小组想研究燃烧的条件,设计了如图二个实验方案,下列关于方案设计说法不合理的是( )
 某化学小组想研究燃烧的条件,设计了如图二个实验方案,下列关于方案设计说法不合理的是( )
某化学小组想研究燃烧的条件,设计了如图二个实验方案,下列关于方案设计说法不合理的是( )| A. | 方案一想通过铜片上白磷和红磷的现象对比,说明可燃物燃烧必须达到一定温度 | |
| B. | 方案二想通过试管中白磷和水中白磷的现象对比,说明可燃物燃烧必须达到一定温度 | |
| C. | 方案二比方案一的设计更环保 | |
| D. | 方案二的两个试管应装有氧气或空气 |

 小红在户外活动时,对溪水进行简单净化,如图:
小红在户外活动时,对溪水进行简单净化,如图: