题目内容
19.食用碱的主要成分是Na2CO3(常含有少量的NaCl),课外探究小组为测定市售食用碱中Na2CO3的含量,设计了如图实验装置.
设计思路:用空气将装置B中生成的二氧化碳缓缓吹入装置D中,利用装置D的质量变化测定食用碱中Na2CO3的含量,请结合实验装置和设计思路,回答下面问题:
(1)装置D中发生反应的化学方程式为Ba(OH)2+CO2═BaCO3↓+H2O;
(2)装置E的作用是吸收空气中的水蒸气和二氧化碳,防止进入装置D;
(3)缓缓通入空气的目的是使氢氧化钡和二氧化碳完全反应;
(4)若撤出装置A,直接通入空气会导致实验结果偏大(填“偏大”、“偏小”或“不变”,下同),若撤除装置C,对实验结果的影响是偏大.
分析 (1)根据氢氧化钡和二氧化碳反应生成碳酸钡沉淀和水进行分析;
(2)根据氢氧化钠会与二氧化碳反应,碱石灰会吸收空气中的二氧化碳和水蒸气进行分析;
(3)根据空气通入过快,不能使氢氧化钡和二氧化碳完全反应进行分析;
(4)空气中的二氧化碳会与氢氧化钠反应,如果撤掉A,会使空气中的二氧化碳未除导致实验结果偏大.根据空气中的二氧化碳会与氢氧化钡反应,装置B中产生导出的气体中含有水,如果不除去气体中的水,会使D中测定的二氧化碳的质量增大进行分析.
解答 解:(1)空气中的二氧化碳会与氢氧化钠反应,如果撤掉A,会使空气中的二氧化碳未除导致实验结果偏大.氢氧化钡和二氧化碳反应生成碳酸钡沉淀和水,化学方程式为:Ba(OH)2+CO2=BaCO3↓+H2O;故填:Ba(OH)2+CO2=BaCO3↓+H2O;
(2)氢氧化钠会与二氧化碳反应,碱石灰会吸收空气中的二氧化碳和水蒸气,所以装置A的作用是吸收空气中的二氧化碳,装置E的作用是吸收空气中的水蒸气、二氧化碳,防止进入装置D中;故填:吸收空气中的水蒸气和二氧化碳,防止进入装置D;
(3)空气通入过快,不能使氢氧化钡和二氧化碳完全反应;故填:使氢氧化钡和二氧化碳完全反应;
(4)空气中的二氧化碳会与氢氧化钡反应,装置B中产生导出的气体中含有水,如果不除去气体中的水,会使D中测定的二氧化碳的质量增大.故填:偏大;偏大.
点评 本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、化学计算等,难度中等,根据物质的化学性质,要认真分析,把握实验设计的每个步骤中的实验目的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.分子、原子等粒子构成物质.用我们所学的分子、原子的相关知识解释下列现象,正确的是( )
| A. | 墙内开花墙外香,是由于分子在不断运动 | |
| B. | 冰冻三尺非一日之寒,水结冰时,分子静止不动 | |
| C. | 空气中的氧气、二氧化碳气体经混合,它们的化学性质改变 | |
| D. | 水沸腾后,水分子体积增大,导致水由液态变为气态 |
2.已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素的质量分数为16%,求混合物中铁元素的质量分数为( )
| A. | 28% | B. | 48% | C. | 52% | D. | 56% |
3.下列是几种粒子的结构示意图,有关说法不正确的是( )

| A. | ①和②属同种元素 | B. | ②属于稀有气体元素 | ||
| C. | ①和③的化学性质相似 | D. | ④属于金属元素 |
 A、B、C、D、E是初中化学常见的物质.C为单质;生活中B和D都可用来灭火;E广泛用于玻璃、造纸、纺织、洗涤剂的生产.它们之间的一部分关系如图所示.(图中“-”表示两端的物质能发生化学反应:“→”表示物质间存在转化关系.部分反应物或生成物已略去)
A、B、C、D、E是初中化学常见的物质.C为单质;生活中B和D都可用来灭火;E广泛用于玻璃、造纸、纺织、洗涤剂的生产.它们之间的一部分关系如图所示.(图中“-”表示两端的物质能发生化学反应:“→”表示物质间存在转化关系.部分反应物或生成物已略去)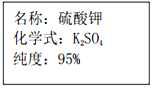 一包钾肥的包装袋上的部分内容如图所示,为确定该化肥纯度(即K2SO4的质量分数)是否符合包装袋上的说明,称取20g样品,加入适量水溶解后,再加入足量的Ba(NO3)2溶液充分反应,得到23.3gBaSO4.通过计算确定该化肥纯度是否符合包装袋上的说明.(假设化肥中杂质不与Ba(NO3)2溶液反应,反应的化学方程式是Ba(NO3)2+K2SO4═BaSO4↓+2KNO3)
一包钾肥的包装袋上的部分内容如图所示,为确定该化肥纯度(即K2SO4的质量分数)是否符合包装袋上的说明,称取20g样品,加入适量水溶解后,再加入足量的Ba(NO3)2溶液充分反应,得到23.3gBaSO4.通过计算确定该化肥纯度是否符合包装袋上的说明.(假设化肥中杂质不与Ba(NO3)2溶液反应,反应的化学方程式是Ba(NO3)2+K2SO4═BaSO4↓+2KNO3)