题目内容
14. 氯化钙钾石的化学式为KCl•xCaC12(x是CaCl2的系数).它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.请回答下列问题:
氯化钙钾石的化学式为KCl•xCaC12(x是CaCl2的系数).它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.请回答下列问题:(1)图中B点时溶液中的溶质是氯化钾、氯化钠以及碳酸钠.
(2)18.55g氯化钙钾石样品中,钾元素的质量分数是21.0%.
(3)所用Na2CO3溶液中溶质的质量分数是多少?(最后一问要求写出计算过程)
分析 由图可以看出,当加入106g碳酸钠溶液时生成10g沉淀,根据碳酸钙的质量和对应的化学方程式可求氯化钙的质量和碳酸钠的质量,进而求算对应的质量分数.
解答 解:图中B点时碳酸钠已经不过,此时的溶质为原样品中的氯化钾,生成的氯化钠和过量的碳酸钠.
设样品中的氯化钙的质量为x,参加反应的碳酸钠的质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100
y x 10g
$\frac{106}{y}$=$\frac{111}{x}$=$\frac{100}{10g}$
x=11.1g
y=10.6g
则18.55g氯化钙钾石样品中,氯化钾的质量18.55g-11.1g=7.45g
所含钾元素的质量为7.45g×$\frac{39}{39+35.5}$×100%=3.9g
18.55g氯化钙钾石样品中,钾元素的质量分数为$\frac{3.9g}{18.55g}$×100%≈21.0%
所用Na2CO3溶液中溶质的质量分数为$\frac{10.6g}{106g}$×100%=10%
故答案为:(1)氯化钾、氯化钠以及碳酸钠.(化学式也可)
(2)21.0%(21%也可).
(3)10%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.端午节吃粽子是传统习俗.贵阳特色粽子的主要配料为下列四种物质,其中富含糖类的是( )
| A. | 糯米 | B. | 火腿肉 | C. | 蛋黄 | D. | 食盐 |
5.推理、类比是化学学习中常用的思维方式,以下类推正确的是( )
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则两者的化学性质相同 | |
| C. | 化合物由不同种元素组成,则只含有一种元素的物质一定不是化合物 | |
| D. | 洗洁精清洗油污利用了乳化作用,则汽油清洗油污也是利用了乳化作用 |
9.酶对生理活动中的化学变化具有催化作用,如唾液淀粉酶能催化淀粉转化为麦芽糖等,但酶的催化效率受温度、酸碱度和激活剂等因素的影响.凡是能提高酶活性的物质都称为激活剂.已知钠离子(Na+)对唾液淀粉酶的催化效率无影响.为了探究氯离子(Cl-)是否为唾液淀粉酶的一种激活剂,小明进行了如下实验设计:
第一步:取小试管2支,按下表中从左到右的药品顺序加入到相应的试管.
第二步:向各试管中加碘液1滴,将2支试管同时放入37℃的水中加热.
(1)小强同学对第二步中“37℃的水”的设定提出自己的观点,他认为把温度控制为相同就可以,改用室温下的水更方便操作.小明认为小强的观点不合理,其理由是人体温度约为37℃,该温度下酶的活性最强;
(2)老师看了小明的实验设计,指出该实验还不能证明氯离子是否为唾液淀粉酶的一种激活剂.小明需如何改进?把0.5%HCl溶液改为0.5%NaCl溶液;
(3)小明改进实验后,若观察到两试管里溶液都变蓝色 ,可得出结论:氯离子(Cl-)不是唾液淀粉酶的激活剂.
第一步:取小试管2支,按下表中从左到右的药品顺序加入到相应的试管.
| 试管号 | 0.5%淀粉溶液 | 0.5%HCl溶液 | 蒸馏水 | 稀释的唾液 |
| 1 | 2mL | 0 | 1mL | 1mL |
| 2 | 2mL | 1mL | 0 | 1mL |
(1)小强同学对第二步中“37℃的水”的设定提出自己的观点,他认为把温度控制为相同就可以,改用室温下的水更方便操作.小明认为小强的观点不合理,其理由是人体温度约为37℃,该温度下酶的活性最强;
(2)老师看了小明的实验设计,指出该实验还不能证明氯离子是否为唾液淀粉酶的一种激活剂.小明需如何改进?把0.5%HCl溶液改为0.5%NaCl溶液;
(3)小明改进实验后,若观察到两试管里溶液都变蓝色 ,可得出结论:氯离子(Cl-)不是唾液淀粉酶的激活剂.
4.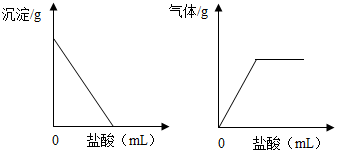 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )| A. | 肯定只存在Na2CO3 | B. | 肯定不存在BaCl2 | ||
| C. | 可能存在Na2SO4 | D. | 可能存在NaOH |
 2012年4月15日,央视《每周质量报告》曝光一些企业用生石灰处理皮革废料熬制工业明胶,制成药用胶囊,最终进入消费者腹中.工业明胶,是一种淡黄色或棕色的碎粒,无不适气味,无肉眼可见杂质.其分子量为1-10万,水分和无机盐含量在16%以下,蛋白质含量在82%以上,是一种理想的蛋白源.
2012年4月15日,央视《每周质量报告》曝光一些企业用生石灰处理皮革废料熬制工业明胶,制成药用胶囊,最终进入消费者腹中.工业明胶,是一种淡黄色或棕色的碎粒,无不适气味,无肉眼可见杂质.其分子量为1-10万,水分和无机盐含量在16%以下,蛋白质含量在82%以上,是一种理想的蛋白源.
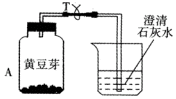 小明为了探究植物也能呼吸,做了以下实验:把装有吸干外表水的黄豆芽的塑料瓶A放在暗处24小时;导管T处用夹子夹住,不让外界空气进入;24小时后,观察塑料瓶壁;把T处夹子打开,用力压A瓶,让瓶内气体通入到右侧烧杯内,发现澄清石灰水变浑浊,塑料瓶内壁有水珠,用温度 计测量豆芽温度,可发现温度升高.
小明为了探究植物也能呼吸,做了以下实验:把装有吸干外表水的黄豆芽的塑料瓶A放在暗处24小时;导管T处用夹子夹住,不让外界空气进入;24小时后,观察塑料瓶壁;把T处夹子打开,用力压A瓶,让瓶内气体通入到右侧烧杯内,发现澄清石灰水变浑浊,塑料瓶内壁有水珠,用温度 计测量豆芽温度,可发现温度升高.