题目内容
18.根据下列装置,结合所学化学知识回答下列问题: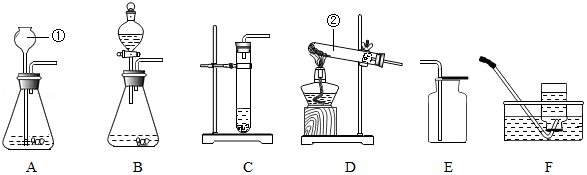
(1)写出图中标号仪器的名称:①长颈漏斗;②试管;
(2)实验室用过氧化氢制取氧气时,如需随时控制反应速率并节约药品,发生装置最好选用B;(填字母,下同),收集装置选用E或F,;其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,反应的基本类型是分解反应.
(3)实验室用高锰酸钾制取氧气时,发生装置应选用D(填字母);其反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,反应的基本类型是分解反应,二氧化锰是该反应的生成物.
(4)如用E装置收集氧气,判断氧气是否收集满的方法是将带火星的木条放在集气瓶口,如果木条复燃,则证明已满;
(5)如果改用氯酸钾和二氧化锰制取氧气,反应前后二氧化锰的质量分数增大(填“增大”、“减小”或“不变”)
(6)在实验室里,可用硫化亚铁固体和稀硫酸的反应来制取硫化氢气体,在通常情况下硫化氢是一种无色、有臭鸡蛋气味的有毒气体,能溶于水且水溶液呈酸性,密度比空气大,实验室制取硫化氢应选用的发生装置是A或B(填字母),实验结束后剩余的硫化氢气体应该用E溶液来吸收.
分析 (1)熟悉常用化学仪器,了解它们的名称及用途;
(2)根据反应物的状态和反应条件选择发生装置和气体的收集方法选择的依据;
(3)根据反应物的状态和反应条件选择发生装置的依据解答;
(4)根据氧气支持燃烧的性质解答.
(5)根据氯酸钾和二氧化锰制取氧气,反应后物质总质量小于反应前物质的质量解答;
(6)根据反应物的状态和反应条件选择发生装置的依据解答;硫化氢气体的性质解答;
解答 解:(1)由图知①是长颈漏斗;b是试管;
(2)实验室用过氧化氢制取氧气的反应物是固体和液体,反应条件是常温,所以发生装置可选用A,氧气密度比空气大,不易溶于水,所以收集装置可选用E、F,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,反应的基本类型是分解反应;
(3)用加热高锰酸钾法制氧气的发生装置的特点属于固体加热型的D装置;反应的方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;反应的基本类型是分解反应;二氧化锰是该反应的生成物;
(4)如用E装置收集氧气,判断氧气是否收集满的方法是将带火星的木条放在集气瓶口,如果木条复燃,则证明已满;
用排水法收集气体时,当集气瓶口有气泡冒出时说明已满.
(5)氯酸钾和二氧化锰制取氧气,反应后物质总质量小于反应前物质的质量;故反应后二氧化锰的质量分数增大;
(6)实验室用硫化亚铁固体跟稀硫酸反应制取硫化氢气体,属于固液在常温下反应制取气体,制取较多的气体可选择A或B来制取;硫化氢气体密度比空气大,能溶于水,因此收集装置应选用E;
故答案:(1)长颈漏斗;试管;
(2)B;E或F;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;分解反应;
(3)D;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;分解反应;生成物;
(4)将带火星的木条放在集气瓶口,如果木条复燃,则证明已满.
(5)增大;
(6)A或B;E.
点评 实验室制取气体,发生装置的选择要看反应物的状态和反应条件,收集装置的选择要看气体的密度和溶解性,当气体比空气的密度大时,用向上排气法收集;当气体的密度比空气的密度小时,用向下排气法收集.当气体不溶于水时,用排水法收集.

 作业辅导系列答案
作业辅导系列答案| A. | CO2、NH3(氨气) | B. | O2、CO2 | C. | N2、CO2 | D. | NO2、CO2 |
| A. | 通入石灰水 | B. | 点燃气体 | ||
| C. | 通入石蕊试液 | D. | 通入灼热的氧化铜 |

(1)填写表格中的空白内容:
| 实验步骤 | 实验现象 | 实验分析 |
| ①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 | 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且石灰水沿右侧导气管进入E | 硬质玻璃管中发生反应的化学方程式为CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,这是一个吸热(填“放热”或“吸热”)反应 |
| ②点燃B处酒精灯,加热一段时间 | B处玻璃管内黑色粉末变红 | 说明CO具有还原性 |
| ③停止通入二氧化碳,熄灭A、B两处的火焰 | C中有D中液体进入 |
(3)实验前,称得玻璃管中B处氧化铜的质量为10g,点燃B处酒精灯,加热一段时间后,玻璃管中B处剩余固体质量为8.4g.求参加反应的氧化铜的质量.(写出计算过程)
