题目内容
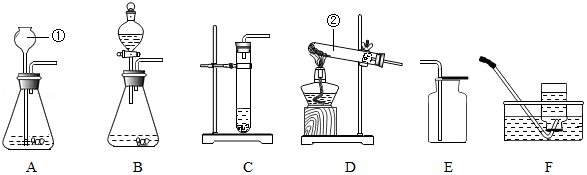
7.某校化学兴趣小组同学进行有关碳及其氧化物的实验(图中夹持已略去).用如图装置,在完成气密性检査后加入药品,并已在装置中充满二氧化碳.
(1)填写表格中的空白内容:
| 实验步骤 | 实验现象 | 实验分析 |
| ①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 | 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且石灰水沿右侧导气管进入E | 硬质玻璃管中发生反应的化学方程式为CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,这是一个吸热(填“放热”或“吸热”)反应 |
| ②点燃B处酒精灯,加热一段时间 | B处玻璃管内黑色粉末变红 | 说明CO具有还原性 |
| ③停止通入二氧化碳,熄灭A、B两处的火焰 | C中有D中液体进入 |
(3)实验前,称得玻璃管中B处氧化铜的质量为10g,点燃B处酒精灯,加热一段时间后,玻璃管中B处剩余固体质量为8.4g.求参加反应的氧化铜的质量.(写出计算过程)
分析 (1)①根据碳还原二氧化碳生成一氧化碳,因此木炭粉减少,过量的二氧化碳能使石灰水变浑浊,同时D装置中液体被进入没有反应的气体压出D装置进入E;碳还原二氧化碳生成一氧化碳,一氧化碳和氧化铜反应生成铜和二氧化碳分析;
②根据一氧化碳还原氧化铜生成铜和二氧化碳,因此B处黑色粉末变为光亮红色,氧化铜失去氧变为铜分析;
③根据玻璃管内的气体随温度降低而压强减小分析;
(2)过量一氧化碳已收集在D中,并没有排放到空气中,不会造成污染.
(3)一氧化碳与氧化铜反应生成铜和二氧化碳,由固体物质减少的质量,利用差量法进行分析解答即可.
解答 解:(1)①点燃A处酒精喷灯一段时间,碳还原二氧化碳生成一氧化碳,因此木炭粉减少,反应产生的二氧化碳及剩余的一氧化碳进入D中,二氧化碳能使石灰水变浑浊,同时D装置中液体被进入没有反应的气体压出D装置进入E;碳还原二氧化碳生成一氧化碳,一氧化碳和氧化铜反应生成铜和二氧化碳,故反应的化学方程式为:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
②点燃B处酒精灯,一段时间,前面碳还原二氧化碳生成一氧化碳,一氧化碳和氧化铜反应生成铜和二氧化碳,因此B处黑色粉末变为红色,说明一氧化碳具有还原性,故反应的化学方程式为:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
③停止通入二氧化碳,熄灭A、B两处火焰,玻璃管内的气体随温度降低而压强减小,因此D中液体倒流入C;
(2)该装置不需要添加尾气处理装置,因为过量一氧化碳已收集在D中,并没有排放到空气中,不会造成污染.
(3)解:设参加反应的氧化铜的质量为x.
CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 固体差量
80 64 80-64=16
x 10g-8.4g=1.6g
则$\frac{80}{16}=\frac{x}{1.6g}$,解得x=8g.
答:参加反应的氧化铜的质量为8g.
故答案为:(1):
| 实验步骤 | 实验现象 | 实验分析 |
| ① | 石灰水沿右侧导气管进入E | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,吸热 |
| ② | 黑色粉末变红 | CO |
| ③ | 有D中液体进入 |
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性;利用差量法是正确解答本题的捷径.

| A. | 为了节约药品,将用剩的药品放回原试剂瓶 | |
| B. | 酒精灯灯翻着火,用湿抹布盖灭 | |
| C. | 用托盘天平称量7.3g药品 | |
| D. | 有腐蚀性的药品直接放在天平托盘上称重 |
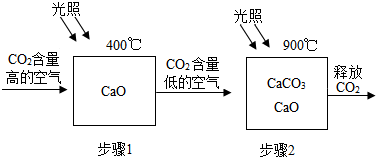
(1)步骤1的化学方程式为CaO+CO2$\frac{\underline{\;400℃\;}}{\;}$CaCO3.
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验方案如表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量固体于试管中,滴加过量稀盐酸溶液. | 试管内有气泡产生. | 分解不完全 |
a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),写出此反应的化学方程式CO2+H2$\frac{\underline{\;一定条件\;}}{\;}$HCOOH.
| A. | 稀盐酸 | B. | 硝酸银溶液 | C. | 硫酸亚铁溶液 | D. | 硫酸锌溶液 |

(1)甲同学向装有氢氧化钙溶液的试管中倒入一定量的稀盐酸,然后滴加酚酞试液,发现酚酞不变色,此现象能(填“能”或“不能”)说明盐酸与氢氧化钙发生了反应.
(2)乙同学向滴有酚酞的氢氧化钠溶液中逐渐加入稀盐酸,边滴加边振荡,乙同学意外发现有气泡产生,说明该氢氧化钠溶液已变质,变质的原因2NaOH+CO2=Na2CO3+H2O(用化学方程式表示).
(3)丙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论.
| 实验操作 | 实验现象 | 实验结论 |
| 取样少许于试管中,先滴加过量CaCl2溶液[或BaCl2、Ba(NO3)2、Ca(NO3)2],再滴加酚酞溶液 | 有白色沉淀生成, 酚酞溶液变红 | 氢氧化钠溶液部分变质 |
(5)丙同学要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的AC.
A.氢氧化钡溶液 B.硝酸钡溶液 C.氢氧化钙溶液 D.氯化钠溶液.